表皮セラミドによる透過性バリア形成
2023.11.21
木原章雄*
*北海道大学大学院薬学研究院
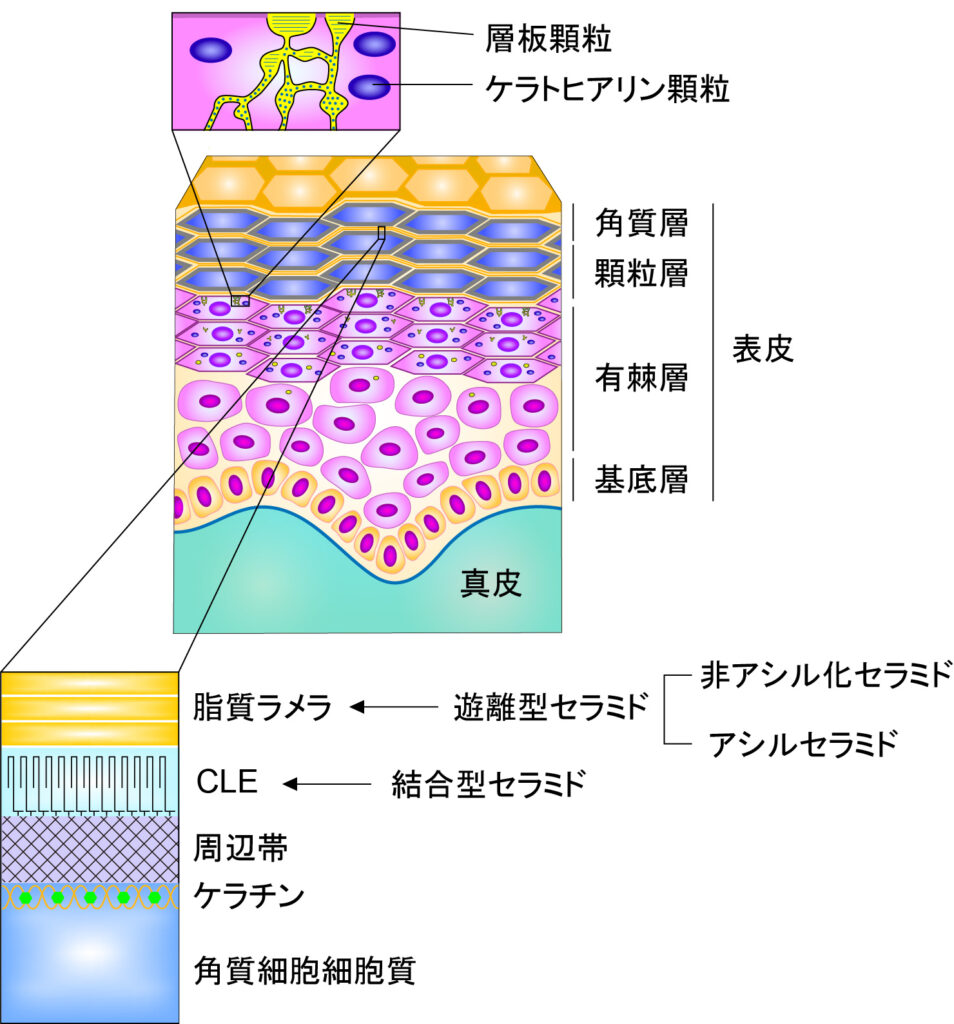
表皮は基底層,有棘層,顆粒層,角質層の四層から構成されており,最外層の角質層が主に皮膚の透過性のバリア(皮膚バリア)を形成している(図1)。皮膚バリアは感染症,炎症,アレルギー疾患の原因となる病原体,異物,アレルゲンの侵入を防ぎ,体内からの水分の損失を抑えるという重要な役割をもつ。そのため,バリア機能の低下は感染症,アトピー性皮膚炎,魚鱗癬,乾皮症などの皮膚疾患のリスク増大あるいは原因となる1, 2)。
図1 表皮の構造
皮膚バリア形成で重要な役割を果たす角質層の構造体のうち,セラミドは脂質ラメラと角質細胞脂質エンベロープ(CLE)の構成成分である。脂質ラメラは角質細胞間に存在する脂質の多層構造体であり,ヒトには13 nmの長周期層と6 nmの短周期層の層が見られる3)。このうち13 nmの長周期層が生物種を問わず共通して見られることから皮膚バリアに重要であると推測されている。脂質ラメラの主成分はセラミド,コレステロール,遊離脂肪酸である。セラミドはタンパク質と共有結合していない遊離型と共有結合した結合型に大別されるが,脂質ラメラを構成するセラミドは遊離型である。CLEは角質細胞の表面を覆う細胞膜様の構造体であり,周辺帯タンパク質と結合した結合型セラミドによって構成される4, 5)。周辺帯はタンパク質の架橋構造体であり,角質細胞に物理的な強度を与えている6)。角質細胞は外界と接した厳しい環境下にあり,かつ様々な環境変化にも対応しなくてはならない。そのため,角質細胞は通常の脂質二重膜のような脆弱な膜構造ではなく,CLEのような共有結合性の強固な脂質構造体を必要としたのであろう。角質層に存在するセラミドは主に顆粒層で産生される。顆粒層で産生されたセラミドのほとんどはグルコシル化されてグルコシルセラミドとなった後に層板顆粒内に蓄えられる7)。ただし,一部のセラミドはホスホコリンが付加されたスフィンゴミエリンとして層板顆粒内に蓄えられる7)。層板顆粒は顆粒と名前がついているが,最近の研究からチューブ状のネットワーク構造であると考えられる8)。層板顆粒に蓄えられたグルコシルセラミド/スフィンゴミエリンは顆粒層と角質層の境界部で細胞外へ放出され,極性基が除去されてセラミドに戻る。
セラミドは長鎖塩基と脂肪酸がアミド結合した構造をもつ。ヒトには5種類の長鎖塩基(スフィンゴシン[S],ジヒドロスフィンゴシン[DS],フィトスフィンゴシン[P],6-ヒドロキシスフィンゴシン[H],4,14-スフィンガジエン[SD])と5種類の脂肪酸(非水酸化脂肪酸[N],α-水酸化脂肪酸[A],ω-水酸化脂肪酸[O],エステル化ω-水酸化脂肪酸[EO],タンパク質結合ω-水酸化脂肪酸[P-EO/P-O])の組み合わせからなる25クラスのセラミドが存在し,それぞれのクラスは脂肪酸と長鎖塩基の略号の組み合わせで表記される(例:NS,EOSなど;図2A, B)。EOをもつセラミドはアシルセラミドと呼ばれ,エステル化された脂肪酸のほとんどはリノール酸である(図2C)。遊離型セラミドのうち,アシルセラミド以外を非アシル化セラミドと呼ぶ。脂質ラメラを構成するセラミドの多くは非アシル化セラミドである。アシルセラミドは非アシル化セラミドに比べて量的には少ないが,その特徴的な構造によって脂質ラメラの多層構造を形成/維持する役割をもつため,皮膚バリア形成において重要である。アシルセラミドの一部は結合型セラミドへと変換される。この過程では,リノール酸に含まれる二重結合が過酸化,エポキシ/水酸化,エポキシ/エノン化と連続的に修飾を受ける5, 9)。結合型セラミドの構造に関して,修飾を受けたリノール酸がリパーゼによって除去されて,ω-水酸化セラミドとなった後,ω-水酸基部分でタンパク質のグルタミン酸残基とエステル結合するという構造モデル(図2A;タンパク質結合ω-水酸化脂肪酸[P-O]モデル)が長年信じられてきた10)。一方,2020年にエポキシ/エノン化したアシルセラミドのエノン部分がタンパク質とマイケル付加反応あるいはシッフ塩基形成をしているという新たな構造モデル(図2A;タンパク質結合修飾リノール酸エステル化ω-水酸化脂肪酸[P-EO]モデル)が提唱された9)。筆者らは最近,このP-EOモデルの結合型セラミドの構造決定と実際の表皮における存在の有無について検討を行った。その結果,マウス表皮においてP-EOタイプの結合型セラミドの存在を確認し,それらがマイケル付加反応でシステイン残基に結合したものであることを明らかにした11)。一方,少なくとも我々の測定条件下では従来から提唱されてきたP-Oタイプの結合型セラミドおよびシステイン残基以外に結合したP-EOセラミドは検出されなかった。
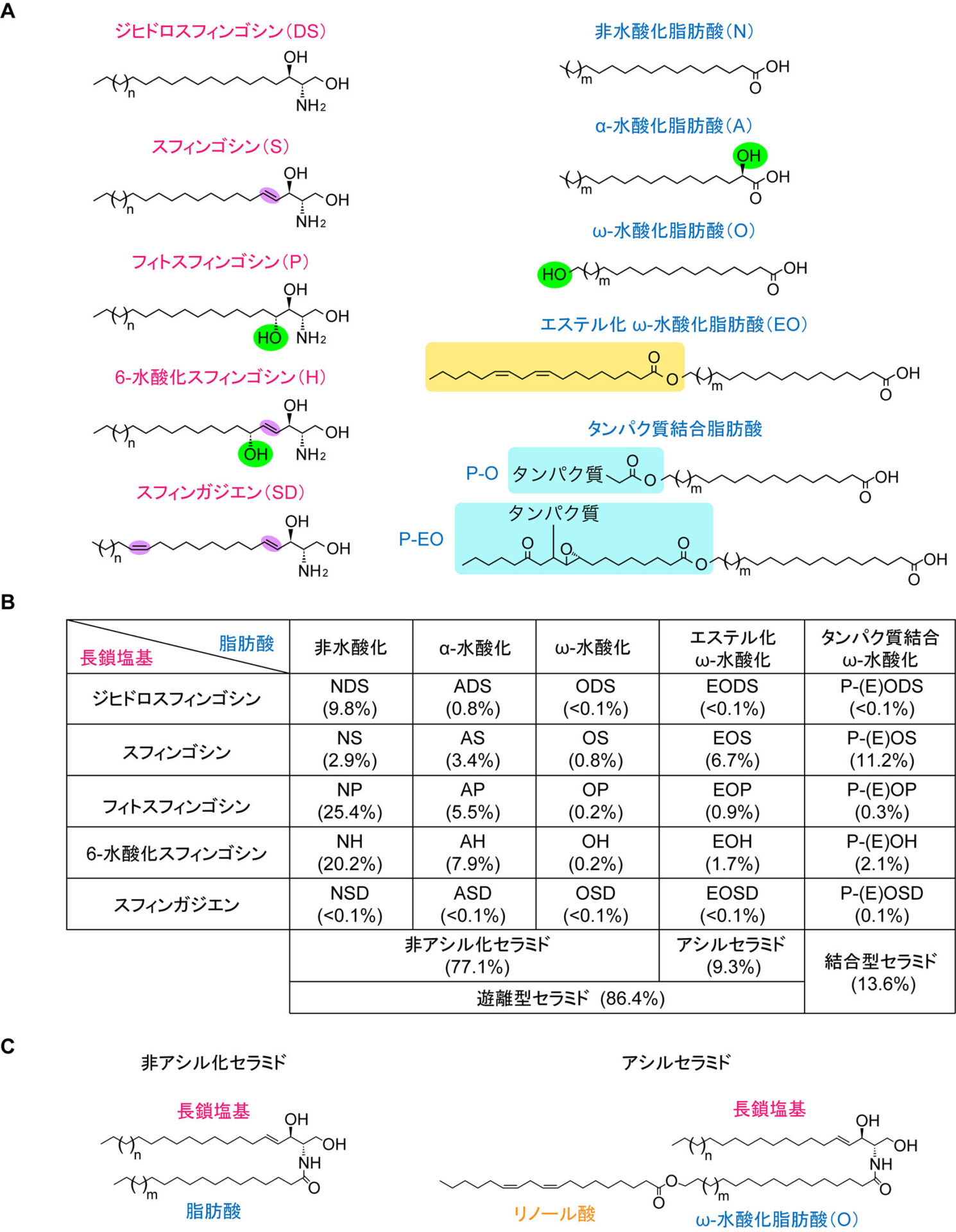 図2 セラミドの構造,クラス,ヒト角質層におけるクラス組成
図2 セラミドの構造,クラス,ヒト角質層におけるクラス組成
(A)ヒトに存在する長鎖塩基(左)と脂肪酸(右)の構造
(B)セラミドクラスの表記法とヒト角質層における各クラスの存在比(括弧内の%)
(C)非アシル化セラミドとアシルセラミドの構造
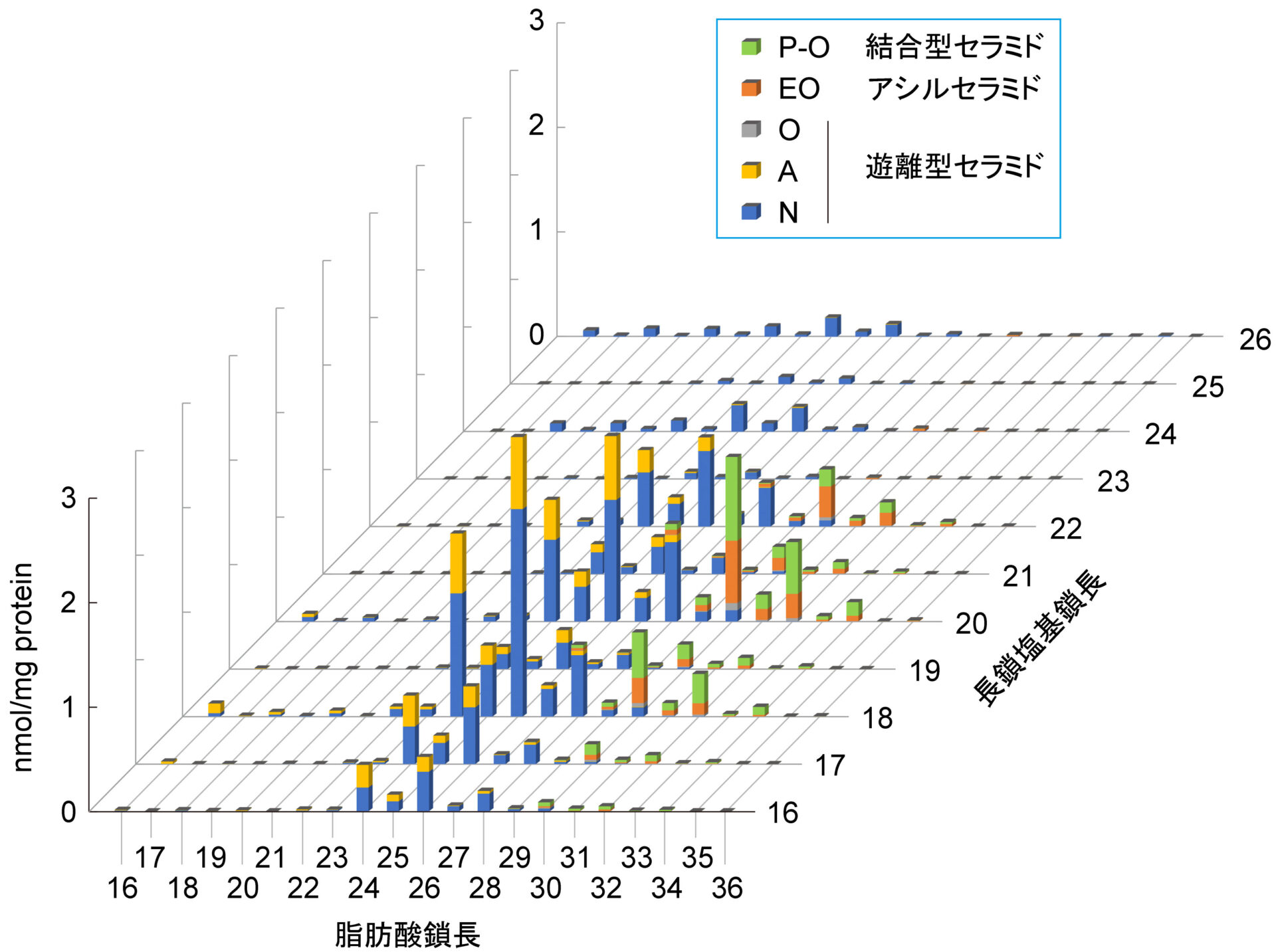
多くの哺乳類組織のセラミド組成は比較的単純であり,一般的な組織に存在するセラミドクラスはほぼNS,NDS,NSDのみである。このうち,NSが最も主要であり,NSDは腎臓に多く存在する12)。また,NPは表皮,食道,小腸,大腸,腎臓などの上皮系の組織に存在し,ASは脳のミエリン,胃,顎下腺に多く存在する13, 14)。一方,表皮には多様かつ多量のセラミドが存在し,EO含有セラミド(アシルセラミド)やH含有セラミドは表皮と後述するように口腔から食道にかけての消化管上部にのみ存在する16-17)。それぞれのクラスには脂肪酸および長鎖塩基の鎖長(脂肪酸には不飽和度の違いも)が異なった複数のセラミド分子種が存在する18, 19)。筆者らは表皮角質層のセラミドを分離・定量できる質量分析法(液体クロマトグラフィー連結タンデム質量分析法;LC-MS/MS)を確立し,2020年にまず長鎖塩基鎖長をC18に絞った解析によってヒト角質層に26クラス/408分子種,マウスに21クラス/342分子種のセラミドが存在することを明らかにした15)。さらに2022年に,長鎖塩基鎖長をC16からC26に拡大した解析によって,ヒト角質層に23クラス/1581分子種のセラミドが存在することを明らかにし,ヒト角質層のセラミドの全容を解明することに成功した16)。後者の解析においてセラミドクラス数が減少しているのは,微量のセラミドをカウントしなかったためである。なお,この解析における結合型セラミドの測定では,結合型セラミドをアルカリ処理することによってO型セラミド(P-OタイプとP-EOタイプの結合型セラミド両方に共通した成分)に変換して測定しているため,両者の区別はできていない。
一般的な組織におけるセラミドの脂肪酸鎖長がC16からC24,長鎖塩基鎖長がほとんどC18に限られるのに対し,ヒト角質層セラミド中の脂肪酸鎖長はC16からC36,長鎖塩基鎖長はC16からC26と幅広い16, 20)(図3)。角質層セラミド中の脂肪酸の長さはクラスによって特徴が見られる。非アシル化セラミド中のN型とA型セラミドすなわち,非水酸化脂肪酸あるいはα-水酸化脂肪酸をもつセラミドの脂肪酸鎖長はC16からC28であり,そのうちC24とC26が多い16)。一方,非アシル化セラミド中のO型,アシルセラミド,結合型セラミドの脂肪酸(ω-水酸化脂肪酸)部分の鎖長はC28からC36であり,そのうちC30,C32,C34が多い。
ヒトの角質層にはフィトスフィンゴシン(P)あるいは6-水酸化スフィンゴシン(H)をもつP型,H型セラミドが多いことが特徴である。総セラミド量に対する割合はNPが25.4%,NHが20.2%,APが5.5%,AHが7.9%であり,これらは合計して約6割にも達する16)(図3B)。これらの長鎖塩基にはNSなどの一般的な組織に多いスフィンゴシンよりも1つ水酸基が多く,この水酸基を介した水素結合によって脂質ラメラにおける脂質ー脂質間相互作用を強めていると思われる。一方,長鎖塩基の中で唯一シス二重結合をもつ4,14-スフィンガジエン(SD)を含むSD型セラミドは角質層にはほとんど存在しない。その原因は14位のシス二重結合が脂質ラメラ中での脂質の密なパッキングを妨げるからであろう。アトピー性皮膚炎患者では,表皮のセラミドの量の低下,クラス組成の変化,脂肪酸の短鎖化が生じることが知られている21-23)。このうち,クラス組成の変化では非アシル化セラミドNP,APとアシルセラミドEOS,EOH,EOPの減少が見られる。
スフィンゴシンを含有するS型セラミドおよびフィトスフィンゴシンを含有するP型セラミド(フィトセラミド)はジヒドロスフィンゴシンをもつDS型セラミド(ジヒドロセラミド)のそれぞれ4位不飽和化あるいは4位水酸化によって生じる。これらを触媒する酵素はそれぞれDEGS1とDEGS2である。DEGS2は水酸化活性だけでなく,不飽和化活性ももつ二機能酵素である24)。DEGS2が産生するフィトセラミドNPはヒト角質層において最も量が多いセラミドクラスであり16),皮膚バリア機能に重要な役割を果たしていると思われる。一方,マウス表皮角質層におけるNP量は少なく(全体の約1%),Degs2 KOマウスは皮膚バリア異常を示さない13)。
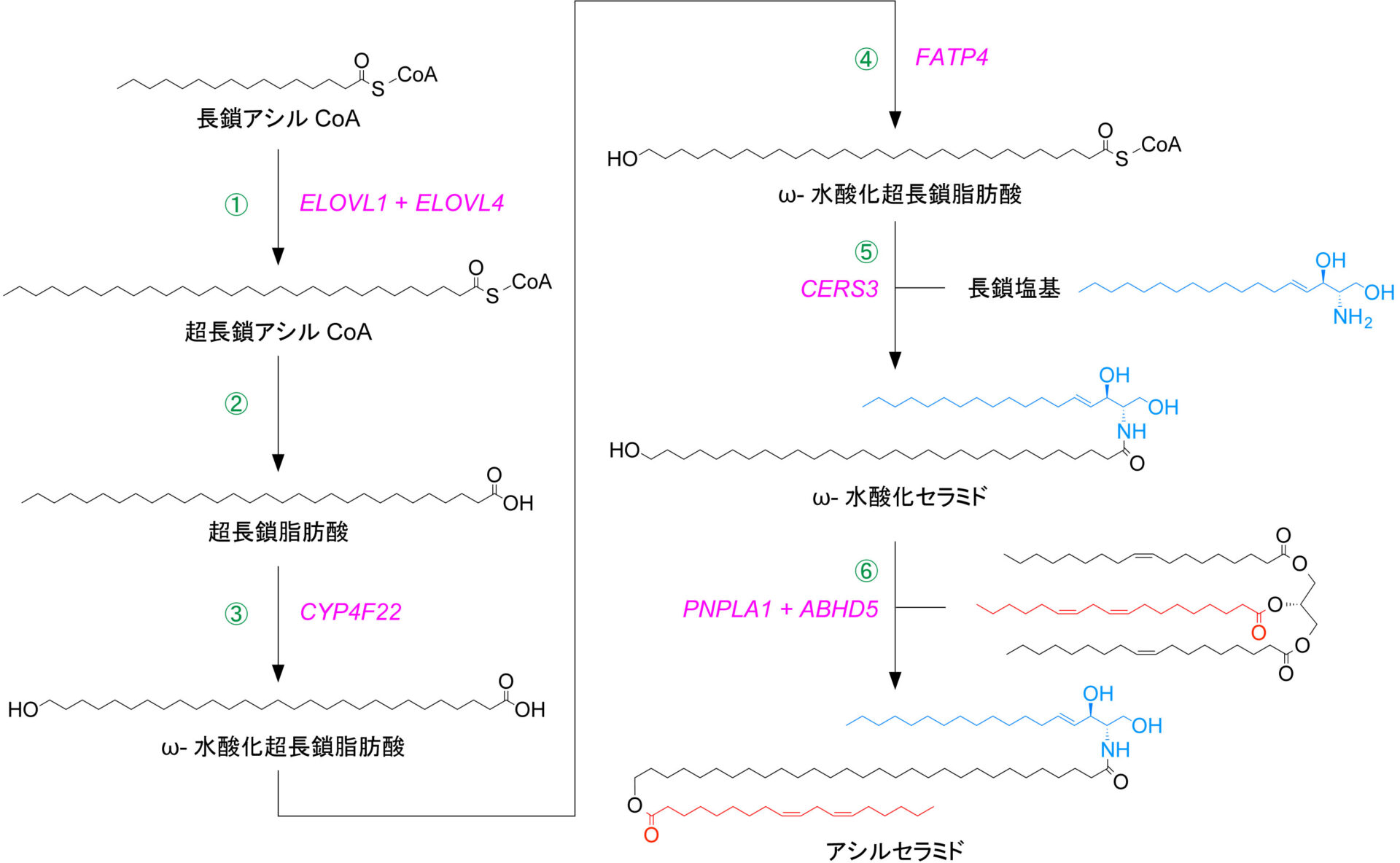
上述の通り,アシルセラミドは脂質ラメラの形成/維持,結合型セラミドはCLE形成に関わるため,これらは皮膚バリア形成に極めて重要である。アシルセラミドおよび結合型セラミド形成に関わる遺伝子の多くは2010年以降に同定された。これらの遺伝子の変異はいずれもヒトでは先天性魚鱗癬を引き起こし,遺伝子KOマウスは皮膚バリア異常で新生致死となる2, 25)。筆者らの研究室ではアシルセラミド形成に関わる遺伝子の多くを同定し,その産生経路の詳細(反応の基質,順序,種類)について解明してきた。アシルセラミド合成経路における6つの反応は下記の通りである。
- 長鎖アシルCoAの超長鎖アシルCoAへの伸長(図4-①):脂肪酸伸長酵素ELOVL1がC26まで,ELOVL4がC30-36までアシルCoAを伸長させる。筆者らはElovl1 KOマウスが≧C26セラミドとアシルセラミド量の低下を伴った皮膚バリア異常を示すこと26),ELOVL1がC20-26アシルCoAに対してin vitroで活性を示すこと27),ヒトにおいてELOVL1変異が魚鱗癬症状を伴った神経皮膚疾患を引き起こすことを明らかにした28)。
- 超長鎖アシルCoAからのCoA脱離による超長鎖脂肪酸産生(図4-②)
- 超長鎖脂肪酸のω-水酸化によるω-水酸化超長鎖脂肪酸産生(図4-③):筆者らはシトクロームP450メンバーCYP4F22(マウスではCyp4f39)が超長鎖脂肪酸のω-水酸化を触媒することを細胞発現系,in vitroでの解析,変異体の活性測定,CYP4F22変異をもつ先天性魚鱗癬患者の角質層のアシルセラミド量の測定などから明らかにした29)。また,Cyp4f39 KOマウスを作成し,アシルセラミド産生不全による皮膚バリア異常と新生致死性を見出した30)。CYP4F22は常染色体潜性先天性魚鱗癬の原因遺伝子である。
- ω-水酸化超長鎖脂肪酸へのCoA付加によるω-水酸化超長鎖脂肪酸アシルCoAの産生(図4-④):筆者らはアシルCoA合成酵素 FATP4(ACSVL4)が触媒することをin vitroでの解析によって証明し,Fatp4 KO マウス中でアシルセラミド量が大きく低下することを示した31)。FATP4は魚鱗癬未熟児症候群の原因遺伝子である。
- ω-水酸化超長鎖脂肪酸アシルCoAと長鎖塩基の縮合によるω-水酸化セラミド産生(図4-⑤):セラミド合成酵素CERS3がこの反応を触媒する32)。
- ω-水酸化セラミドとリノール酸間のエステル結合形成によるアシルセラミド産生(図4-⑥):筆者らはトランスアシラーゼPNPLA1が触媒することをin vitro,細胞系(過剰発現およびノックダウン)の解析から解明した33)。また,リノール酸の供給源はリノレオイルCoAではなく,トリグリセリドであることをin vitroの解析によって示し,PNPLA1がアシルトランスフェラーゼではなく,トランスアシラーゼであることも見出した。さらに,ABHD5がPNPLA1によるトリグリセリド利用を促進させる働きがあることを明らかにした34)。PNPLA1とABHD5はそれぞれ常染色体潜性先天性魚鱗癬,シャナリン・ドルフマン症候群の原因遺伝子である。
アシルセラミド,結合型セラミドが表皮だけでなく,マウスの口腔から前胃の粘膜上皮にも存在し,口腔バリア形成に重要な役割を果たしていることを筆者らは最近見出した17)。これらの組織で脂肪酸伸長酵素遺伝子Elovl1が欠損したコンディショナルKOマウスでは,食道と舌の形態異常,蛍光色素の浸透亢進,カプサイシン飲料に対する忌避行動が観察された。また,ヒトにおいても,少なくとも解析した頬粘膜と歯肉にはアシルセラミドが存在し,歯肉には結合型セラミドもが存在していた。このように表皮だけと思われていた透過性バリア形成におけるセラミドの重要性が,口腔(とおそらく消化管上部)にも拡大した。
付記
本コンテンツの著作権所有者は著者に帰属し,日本セラミド研究会(札幌,日本)は本コンテンツを当会Webサイトへ掲載できる非独占的通常実施権者になっています.
本コンテンツは,クリエイティブ・コモンズ の定めたCC BY 4.0ライセンスの条件で掲載しており,著者と著作権所有者が明記され,かつ,日本セラミド研究会からの出版物である旨が引用されていることを条件として,他の会での使用,配布,または複製は許可されています.これらの条件に準拠していない使用,配布,または複製は許可されていません.
CC BY 4.0ライセンスの内容については以下URLを参照してください.
https://creativecommons.org/licenses/by/4.0/
引用文献
1) Goleva E, et al.: Epithelial barrier repair and prevention of allergy. J Clin Invest, 129, 1463-1474 (2019)
2) Hirabayashi T, et al.: The role of PNPLA1 in ω-O-acylceramide synthesis and skin barrier function. Biochim Biophys Acta, 1864, 869-879 (2019)
3) Bouwstra JA, et al.: Structure of the skin barrier and its modulation by vesicular formulations. Prog Lipid Res, 42, 1-36 (2003)
4) Elias PM, et al.: Formation and functions of the corneocyte lipid envelope (CLE). Biochim Biophys Acta, 1841, 314-318 (2014)
5) Munoz-Garcia A, et al.: The importance of the lipoxygenase-hepoxilin pathway in the mammalian epidermal barrier. Biochim Biophys Acta, 1841, 401-408 (2014)
6) Candi E, et al.: The cornified envelope: a model of cell death in the skin. Nat Rev Mol Cell Biol, 6, 328-340 (2005)
7) Uchida Y, et al.: Omega-O-acylceramide, a lipid essential for mammalian survival. J Dermatol Sci, 51, 77-87 (2008)
8) Norlén L, et al.: A cryotransmission electron microscopy study of skin barrier formation. J Invest Dermatol, 120, 555-560 (2003)
9) Takeichi T, et al.: SDR9C7 catalyzes critical dehydrogenation of acylceramides for skin barrier formation. J Clin Invest, 130, 890-903 (2020)
10) Marekov LN, et al.: Ceramides are bound to structural proteins of the human foreskin epidermal cornified cell envelope. J Biol Chem, 273, 17763-17770 (1998)
11) Ohno Y, et al.: Determining the structure of protein-bound ceramides, essential lipids for skin barrier function. iScience, 26, 108248 (2023)
12) Jojima K, et al.: Biosynthesis of the anti-lipid-microdomain sphingoid base 4,14-sphingadiene by the ceramide desaturase FADS3. FASEB J, 34, 3318-3335 (2020)
13) Ota A, et al.: Bifunctional DEGS2 has higher hydroxylase activity toward substrates with very-long-chain fatty acids in the production of phytosphingosine-ceramides. J Biol Chem, 299, 104603 (2023)
14) Mori K, et al.: Role of 2-hydroxy acyl-CoA lyase HACL2 in odd-chain fatty acid production via α-oxidation in vivo. Mol Biol Cell, 34, ar85 (2023)
15) Kawana M, et al.: Comparative profiling and comprehensive quantification of stratum corneum ceramides in humans and mice by LC/MS/MS. J Lipid Res, 61, 884-895 (2020)
16) Suzuki M, et al.: Whole picture of human stratum corneum ceramides, including the chain-length diversity of long-chain bases. J Lipid Res, 63, 100235 (2022)
17) Sassa T, et al.: Involvement of ω-O-acylceramides and protein-bound ceramides in oral permeability barrier formation. Cell Rep, 42, 112363 (2023)
18) Masukawa Y, et al.: Characterization of overall ceramide species in human stratum corneum. J Lipid Res, 49, 1466-1476 (2008)
19) t’Kindt R, et al.: Profiling and characterizing skin ceramides using reversed-phase liquid chromatography-quadrupole time-of-flight mass spectrometry. Anal Chem, 84, 403-411 (2012)
20) Kihara A: Synthesis and degradation pathways, functions, and pathology of ceramides and epidermal acylceramides. Prog Lipid Res, 63, 50-69 (2016)
21) Imokawa G, et al.: Decreased level of ceramides in stratum corneum of atopic dermatitis: an etiologic factor in atopic dry skin? J Invest Dermatol, 96, 523-526 (1991)
22) Ishikawa J, et al.: Changes in the ceramide profile of atopic dermatitis patients. J Invest Dermatol, 130, 2511-2514 (2010)
23) Yokose U, et al.: The ceramide [NP]/[NS] ratio in the stratum corneum is a potential marker for skin properties and epidermal differentiation. BMC Dermatol, 20, 6 (2020)
24) Ternes P, et al.: Identification and characterization of a sphingolipid ∆4-desaturase family. J Biol Chem, 277, 25512–25518 (2002)
25) Akiyama M: Acylceramide is a key player in skin barrier function: insight into the molecular mechanisms of skin barrier formation and ichthyosis pathogenesis. FEBS J, 288, 2119-2130 (2021)
26) Sassa T, et al.: Impaired epidermal permeability barrier in mice lacking Elovl1, the gene responsible for very-long-chain fatty acid production. Mol Cell Biol, 33, 2787-2796 (2013)
27) Ohno Y, et al.: ELOVL1 production of C24 acyl-CoAs is linked to C24 sphingolipid synthesis. Proc Natl Acad Sci USA, 107, 18439-18444 (2010)
28) Mueller N, et al.: De novo mutation in ELOVL1 causes ichthyosis, acanthosis nigricans, hypomyelination, spastic paraplegia, high frequency deafness and optic atrophy. J Med Genet, 56, 164-175 (2019)
29) Ohno Y, et al.: Essential role of the cytochrome P450 CYP4F22 in the production of acylceramide, the key lipid for skin permeability barrier formation. Proc Natl Acad Sci USA, 112, 7707-7712 (2015)
30) Miyamoto M, et al.: Severe skin permeability barrier dysfunction in knockout mice deficient in a fatty acid ω-hydroxylase crucial to acylceramide production. J Invest Dermatol, 140, 319-326 (2020)
31) Yamamoto H, et al.: Skin permeability barrier formation by the ichthyosis-causative gene FATP4 through formation of the barrier lipid ω-O-acylceramide. Proc Natl Acad Sci USA, 117, 2914-2922 (2020)
32) Jennemann R, et al.: Loss of ceramide synthase 3 causes lethal skin barrier disruption. Hum Mol Genet, 21, 586-608 (2012)
33) Ohno Y, et al.: PNPLA1 is a transacylase essential for the generation of the skin barrier lipid ω-O-acylceramide. Nat Commun, 8, 14610 (2017)
34) Ohno Y, et al.: Molecular mechanism of the ichthyosis pathology of Chanarin-Dorfman syndrome: Stimulation of PNPLA1-catalyzed ω-O-acylceramide production by ABHD5. J Dermatol Sci, 92, 245-253 (2018)