セラミド研究史概略
2023.10.16
花田賢太郎1*、平林義雄2*
1*, 国立感染症研究所 品質管理研究センター;2*, 理化学研究所 研究開拓本部; 順天堂大学医学部、環境医学研究所
1.はじめに
長鎖アミノアルコールlong-chain amino alcoholの一種である長鎖塩基(long-chain base;スフィンゴイド塩基sphingoid baseともいう)を骨格としてもつ一群の脂質がスフィンゴ脂質である。長鎖塩基の詳細な化学構造は進化系統樹的に遠く離れた生物種間で異なるものの、スフィンゴ脂質は全ての真核生物および一部の原核生物に存在すると考えられている。
長鎖塩基のアミノ基にアシル基がアミド結合したものが広義のセラミドceramideであり、セラミドにさまざまな親水性の頭部が結合してものが複合スフィンゴ脂質と呼ばれる(図1)。
狭義のセラミドはスフィンンゴシンsphingosineのN-アシル化体に特化され、ジヒドロスフィンンゴシンdihydrosphingosineやフィトスフィンンゴシンphytosphingosineのN-アシル化体はそれぞれジヒドロセラミドdihydroceramide、フィトセラミドphytoceramideと区別して呼ばれる。
スフィンゴ脂質の名称は、スフィンゴ脂質の最初の発見者であるJ.L.W. Thudichumが130年以上も前に名付けた。ギリシア神話に登場する謎かけの怪獣スフィンクスSphinxに通じるこの名称は、謎の脂質に相応しい魅力的な名前である1)。
その後、特に20世紀の後半になり、スフィンゴ脂質は親水基を構成している多様な糖鎖と共に多様なセラミド分子の組み合わせで、1000を優に超える数の分子種が自然界に存在していることが精密な化学分析で明らかにされてきた。その結果、それぞれの生物種や臓器・器官、さらには細胞内小器官で特徴的なスフィンゴ脂質組成が示されること、さらに最近の研究によりセラミドを中心として、分子多様性と多彩な機能との関連が次第に明らかにされつつある。
スフィンゴ脂質全般の構造・代謝・機能の詳細は本研究会WEBサイトに掲載する他の総説に譲り、本稿では主に哺乳動物由来のセラミドに焦点を絞ってその構造決定や命名から最新潮流に至る研究の流れの概略を述べる。なお、本文中で記載した研究者の国名や所属機関名は当該研究発表当時のものである。
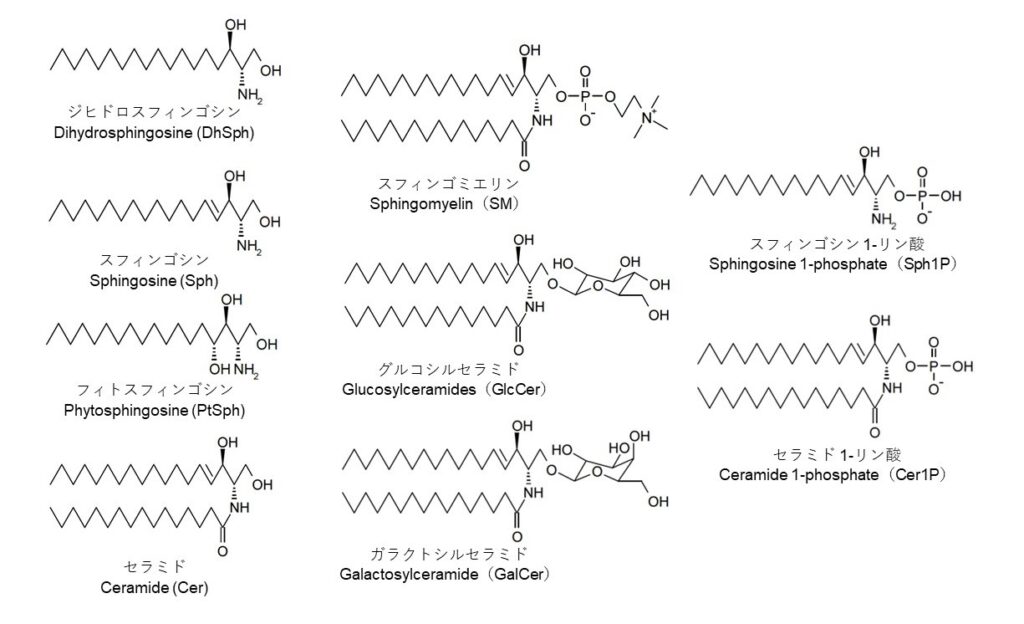
図1 哺乳動物における主たるセラミド関連分子の化学構造
2.セラミド研究の源流を訊ねて
ドイツのHensingが脳試料の化学組成を解析してリン含有物質の存在を1719年に報告したことが近代の生体脂質研究の幕開けと見なされているが、その後、フランスのGobleyが卵黄からリン含有物質を単離してレシチン(lecithin:今でいうところのホスファチジルコリンphosphatidylcholine; PC)と命名するに至るのは1846年とかなり時代が下がる2)。そして、ドイツのThudichumが脳の脂質成分をその当時としては網羅的に解析し、それまでに知られていたグリセロリン脂質とは異なりアルカロイドに脂肪酸が結合している成分を見出して、その謎めいたアルカロイドにスフィンゴシン(初期はsphingosineではなくドイツ語相当のsphingosin表記されていた)と命名した1884年、もしくは当該成分を予備的に発表した1874年がスフィンゴ脂質研究幕開けの年とされている3)。
多くの学術用語はギリシャ語もしくはラテン語を起源としている。とくに歴史の長い生物学・医学関係の用語でその傾向がみられる。脳brainのギリシャ語はεγκξφαλος(エンケファロス:encephalos)、ラテン語はcerebrumであり、それらは脳炎encephalitisや大脳皮質cerebral cortexのように汎用学術英語として今に残っている。Thudichumが1884年に上梓した論文において、グルコースと似て非なる脳に豊富にある糖を「脳の糖」という意味でセレブロースcerebroseと名付け、その糖を結合した脂質様物質をセレブロシドcerebrosideと命名した(これらは現在の物質名で言えばそれぞれガラクトースとガラクトシルセラミドに相当する)。
スフィンゴミエリン(sphingomyelin; SM)は、スフィンゴシンと脂肪酸の結合物にさらにリン酸を持つ成分sphingomyelinとして1884年の時点で現在と同じ命名がされている。一方、スフィンゴシンと脂肪酸の結合した構造の呼び方はその当時はまだなく、スフィンゴシンのアミノ基に脂肪酸がアミド結合している化学構造はN-palmitoylsphingosineやacylsphingosinesなどと記載されていた。この構造を包括的にceramideと初めて呼んだのはドイツ・フライブルグFreiburg大学の研究者による1932年の論文中と思われる4) (本研究会Webサイト中の記事『スフィンゴ脂質およびセラミドの命名事始め』も参照)。セレブロシドのアミド結合脂質骨格を短い言葉で示す用語としてセラミドという造語は秀逸である。
3.セラミドの構造と生合成経路および関連遺伝子の同定
セラミドの化学構造はそれ単独というよりもセレブロシドの全体構造を決定するなかで米国のCarterらが1950年代前半までに確立した5)。その途上、スフィンゴシン部分は、二つある不斉炭素により合計4つの立体異性体を区別する必要があるうえ、天然スフィンゴシンを単離するために複合スフィンゴ脂質を比較的強い液性で加水分解する際に立体異性が変化する問題もあり、その構造決定は難航したようである6)。哺乳動物の典型的なセラミドおよびその関連脂質の構造を図1に記載した。他の生物種を含めたより詳細なセラミド関連脂質の構造は本研究会WEBサイトに掲載予定の他の総説を参照していただきたい。
現在明らかになっている哺乳動物および酵母における主たるスフィンゴ脂質の生合成経路を図2に記載した。各ステップの詳細は本研究会WEBサイト中の総説『哺乳動物のセラミド関連脂質生合成』を参照してもらい、本稿ではこのような生合成経路を描けるに至った特に重要な出来事に絞って概説する。
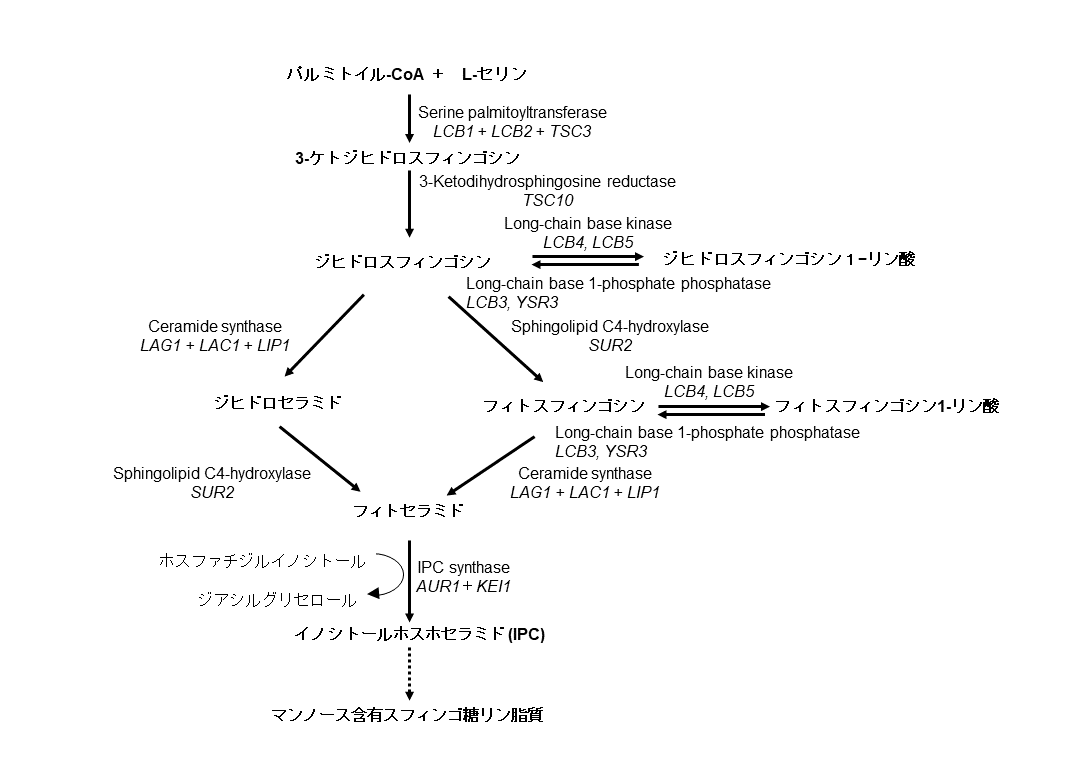
図2A セラミド関連分子の生合成経路(出芽酵母細胞における生合成経路)
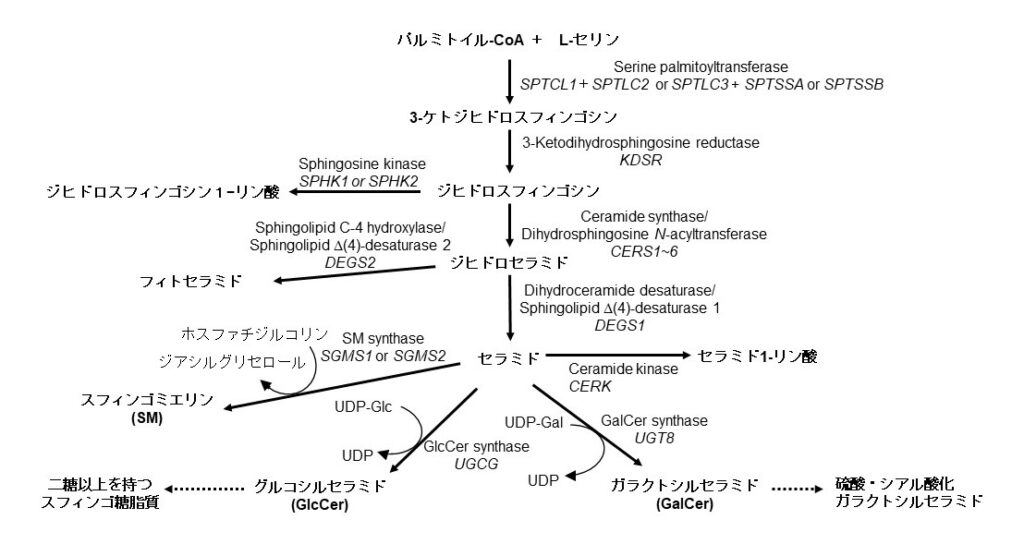
図2B セラミド関連分子の生合成経路(ヒト細胞における生合成経路)
炭素原子18個を持つスフィンゴシンのC1–C2部位はアミノ酸のセリンに、C3–C18部位はパルミチン酸にそれぞれ由来することは放射性前駆体を用いた代謝標識解析から1950年代前半には明らかにされていたが、その当時はスフィンゴ脂質の生合成の最初の段階でスフィンゴシンができると信じられていた6, 7)。1968年、米国のBraunとSnellおよびドイツのStoffelらが酵母Hansenula ciferri(別名Pichia ciferri)の膜画分に、セリンとパルミトイルCoAとを縮合してケトジヒドロスフィンゴシン(3-ketodihydrosphingosine; KDS)を生成させる活性すなわちセリンパルミトイル転移酵素(serine palmitoyltransferase; SPT)活性を発見し、SPTがスフィンゴ脂質生合成の初発段階を担うことが明らかとなった8, 9)。
長鎖塩基とアシルCoAからセラミドを生成させる酵素反応が複数の動物臓器ホモジネート中にあることを米国のSribneyが1966年に報告した10)。なお、セラミダーゼの逆反応により長鎖塩基と脂肪酸から直接セラミドが生成するという説も提出されていたが11)、この説はその後否定されている(ただし、ミトコンドリアではセラミダーゼの逆反応でセラミドの生産が起こるとの主張もある12))。In vitroでの酵素反応ではジヒドロスフィンンゴシンもスフィンンゴシン同様にアシル化されるため、ジヒドロスフィンンゴシンがジヒドロセラミドとなった後にセラミドになるのか、ジヒドロスフィンンゴシンがスフィンンゴシンとなった後にセラミドになるのか、もしくはその両方ともに起きているのかは長い間決着がつかなかった。しかし、後述するようにこの酵素反応の阻害剤が1993年に発見され、生きた細胞中では専らジヒドロスフィンンゴシンがジヒドロセラミドとなった後にセラミドになるということが明確となった13)。
セラミド生合成に関わる様々な酵素の遺伝子の同定は、出芽酵母Saccharomyces cerevisiaeを材料とした遺伝学的アプローチにより端緒が開かれた。米国のLesterとDicksonらは、スフィンゴ脂質合成の欠損したS. cerevisiae変異細胞を相補する遺伝子としてSPTのサブユニットをコードするLCB1遺伝子をクローニングした14, 15)。また、長鎖塩基のアシル転移酵素に関してもS. cerevisiaeの遺伝学的探索から構造の似た二つの膜タンパク質をコードするLAG1, LAC1の両方がアシルCoA依存性セラミド合成に必須であることをスイスのConzelmannらおよびRiezmannらが2001年に発見した16, 17)。その後、これらのホモログとして哺乳動物のSPTやセラミド合成酵素を担う遺伝子群が続々とクローニングされていった7, 18, 19)。なお、酵母のセラミド合成酵素は三種の異なるタンパク質(Lag1p, Lac1p, Lip1p)のヘテロオリゴマーであるが20)、哺乳動物の場合は6つのセラミド合成酵素遺伝子CERS1~6のそれぞれの産物のホモダイマーや異なるCERS産物同士のヘテロダイマーである21)。
ガラクトシルセラミド(GalCer)合成酵素は精製タンパク質の部分アミノ酸配列からcDNAクローニングされた22)。しかし、脂質合成酵素は精製の困難な膜タンパク質が多く、酵母の遺伝子ホモログとしては得られないセラミド代謝関連遺伝子の多くは体細胞遺伝学や生命情報科学bioinformaticsの手法を駆使して同定されてきた。グルコシルセラミド(GlcCer)合成酵素欠損マウスメラノーマ細胞を相補するものとして理研の平林らが1996年に当該酵素遺伝子cDNAを23)、セラミドを小胞体からSM合成の場であるゴルジ体へと運ぶ脂質輸送タンパク質CERTは細胞内セラミド輸送欠損CHO細胞を相補するcDNAとして感染研の花田らが2003年に24)、それぞれクローニングした。SM合成酵素(SMS)に関しては、当該酵素の触媒反応がホスホリパーゼCのそれに類似していることを利用した生命情報科学的探索によりオランダのHolthuisらはSMS1およびSMS2のcDNAを2004年にクローニングし25)、ほぼ時を同じくして、SM合成の欠損したヒト白血球細胞を相補するものとして京大の岡崎らがSMS1 cDNAをクローニングした26)。
セラミドのC1位をCa2+およびATP依存的にリン酸化してセラミド1-リン酸を生産するセラミドキナーゼ活性が脳シナプス小胞にあることを米国のBajjaliehらが1989年に報告し27)、セラミドキナーゼ(の少なくとも一つのアイソフォーム)の遺伝子cDNAはスフィンゴシンキナーゼとの配列類似性を手掛かりに三共の古浜らが2002年に初めてクローニングした28)。
セラミド合成酵素CerSsとアシルCoA合成酵素のACSL5およびジアシルグリセロール(diacylglycerol; DAG)アシル転移酵素のDGAT2は小胞体上で複合体を形成し、DGAT2がアシルCoAを使ってセラミドのC1位の水酸基にアシル基を転移してO-acylceramideを生産させることが最近見出された29)。合成されたアシルセラミドはトリアシルグリセロールと同様に油滴lipid dropletsに蓄積する29)。
スフィンゴ脂質代謝に関わる生合成酵素および分解酵素はその遺伝子を欠失しても細胞培養レベルでは致死的ではない。全ての種類のスフィンゴ脂質の新合成ができなくなるSPT欠失変異細胞でも培地にスフィンゴ脂質があれば生育できる。一方、遺伝子ノックアウトマウス(機能重複のある酵素では重複ノックアウトマウス)の解析から、哺乳動物個体レベルの生育には、SPTからGlcCer合成酵素もしくはSMSに至るほぼ全ての酵素反応は必須と考えられる。唯一の例外がジヒドロセラミドをセラミドに変換するステップであり、ジヒドロセラミド不飽和化酵素(遺伝子名はDegs1またはDes1)の欠失マウスは、不完全浸透性の胎生致死ではあるが、生まれた個体はいくつかの異常を示しつつも体全体がジヒドロセラミド型メインの状態で生育できる30)。この結果は、スフィンゴ脂質の機能の観点からセラミド型とジヒドロセラミド型との差異は、通常の飼育条件下ではかなり微妙なものであることを示唆している31)。
4.セラミドの分解経路と生理的意義、および関連遺伝子の同定
哺乳動物のセラミドおよびセラミドに直結する複合スフィンゴ脂質の分解経路を図3に記載した。生体物質の代謝は合成と分解がバランスよく調整されて成り立っている。リソソームでの物質分解はどの細胞でも恒常的に起こっているhouse-keeping的活動の側面が高いが、外部刺激に応答して一過的に起こる脂質分解は情報伝達メディエータとしての脂質分子の生産のための反応であることが多い。生理活性メディエータとしての脂質研究は、形質膜plasma membraneにおいてホスファチジルイノシトール(phosphatidylinositol; PI)の分解で生じたDAGによりプロテインキナーゼC(protein kinase C; PKC)が活性化されるスキームが英国のBerridgeや神戸大の西塚・高井らによって明らかになった1980年代から急速に発展してきた。本稿では、哺乳動物細胞におけるセラミドおよびそれに近いスフィンゴ脂質の分解機序とその役割が明らかになってきた研究史を手短に振り返る。哺乳動物細胞以外でのセラミド分解や複雑な糖脂質の分解系、また、スフィンゴシン1-リン酸(sphingosine-1-phosphate; Sph1P)生産と関わるセラミド分解の話題は、本研究会Webサイト中の総説『スフィンゴ脂質恒常性維持のためのセラミド分解経路』を参照されたい。
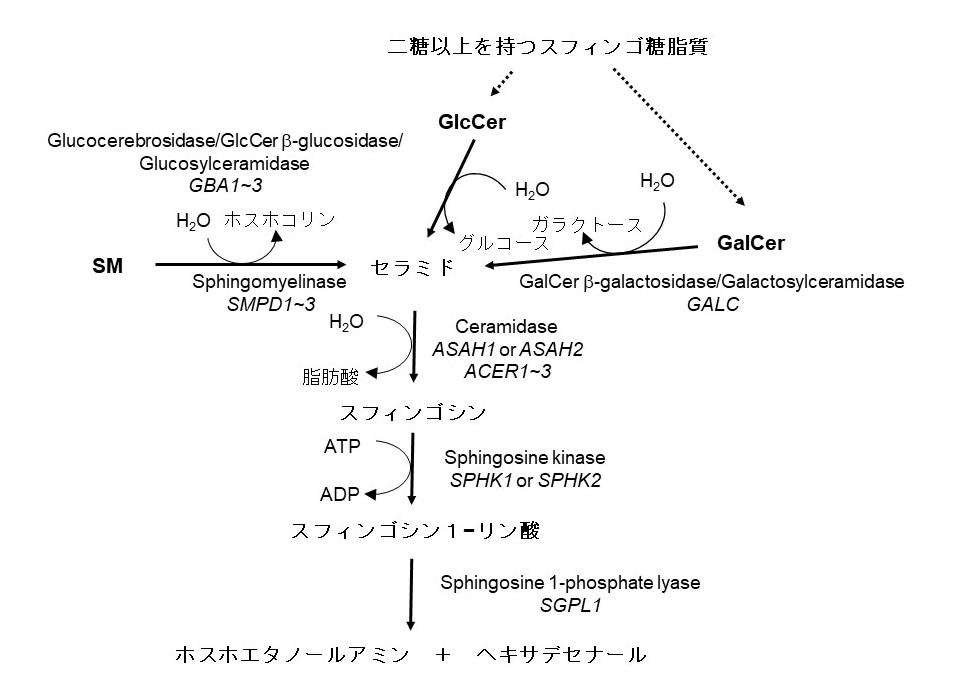
図3 ヒト細胞におけるセラミド関連分子の分解経路
1963年、イスラエルのGattはpH 5付近でセラミドをスフィンゴシンと脂肪酸に加水分解する活性すなわち酸性セラミダーゼ(acid ceramidase; aCERase)をラット脳から部分精製して報告した11)。リソソームにおける脂質分解の重要性は、リピドーシスと総称される遺伝性の脂質代謝異常症の存在により、20世紀中盤ころには認識されていた。ファーバーFarber病はaCERase欠損症であること32)、ゴーシェGaucher病はGlcCer分解酵素(glucocerebrosidase/GlcCer β-glucosidase/glucosylceramidase)の欠損症33, 34)、クラッベKrabbe病はGalCer分解酵素(GalCer β-galactosidase/galactosylceramidase)の欠損症35)、ニーマン・ピックNiemann-Pick病A型およびB型(別名I型およびII型)は至適pHが酸性領域にあるSM分解酵素(acid SMase; aSMase)の欠損症36)、であることは1970年代前半までに明らかになっている。
可溶性のリソソーム脂質分解酵素のいくつかは精製されて遺伝子クローニングもなされ、さらに、自然発生的なマウス変異体の発見やゲノム遺伝子破壊技術によってヒト・リピドーシス病態のモデルマウスが得られるようになった37-41)。リソソームの脂質分解酵素の欠損に起因して脂質が異常に蓄積し、肝脾が肥大し、しばしば精神運動遅滞psychomotor retardationを伴い、重篤な場合は致死的であるといった類似点がリピドーシス全般にあるが、どの分解酵素が欠損しているかで異なる症状もあり、培養細胞レベルでの研究においては進展がみられつつも42)、特定の分解酵素欠損がどのような機序でヒト個体レベルの病状に至るのかは現在でも不明である。
GalCerが蓄積するKrabbe病ではリゾ体GalCerであるサイコシンpsychosineが神経細胞に対する毒性の本体であるとも提唱されている43)が、哺乳動物細胞の複合スフィンゴ脂質のアミドアシル鎖を特異的に脱アシル化する酵素は未だに同定されておらず、GalCerがリソソーム中に大量に蓄積すると酸性セラミダーゼの働きによってサイコシンが生じるようだ44)。
スフィンゴ脂質活性化因子(sphingolipid activator proteins; SAPs)と総称されるタンパク質群は、複合スフィンゴ脂質がリソソーム内で加水分解される際、分解対象となる脂質を膜から引き抜いて分解酵素に渡す役割を担う45)。SAPsの存在を初めて記載したのは、ドイツのMehlとJatzkewitz.が1964年に報告した硫酸化GalCerすなわちスルファチドsulfatideがスルファターゼsulfataseによって脱硫酸化される際に補助因子が必要との記載であろう46)。その後、米国のO’Brienらは、GlcCer分解酵素がGlcCerを分解する反応を促進するタンパク質性因子の存在をゴーシェ病患者試料から部分精製して示し47)、後年、一つの前駆体タンパク質・プロサポシンがタンパク質分解を受けて4種類のSAPs(SAP-A, -B, -C, -D)が生じ、それぞれスフィンゴ脂質分解酵素活性化に特異性を持つことも明らかにした48, 49)。
一方、細胞内メディエータとしてのスフィンゴ脂質分子の役割は、1980年代の後半から萌芽し、その後、爆発的な広がりを見せて今日に至っている。その最初の起爆剤となったのは、リゾ型スフィンゴ脂質や長鎖塩基にPKCの強い阻害活性のあることを米国のBellとHannunらが1987年に報告したことであろう50, 51)。80年代終わりには、ヒト白血病細胞HL-60をビタミンDで処理するとSM分解が亢進されてできたセラミドが細胞分化を促すといういわゆるSMサイクルが岡崎とHannunらにより提唱され52)、ほぼ時を同じくして他の研究グループからも、HL-60細胞をホルボールエステル処理するとSM合成が亢進することや53)、下垂体GH3細胞におけるホルボールエステル誘導分化は細胞を細菌由来SMaseで処理すると抑制されることが報告された54)。90年代に入ると、セラミドとDAGとのバランスが細胞老化に関わるらしいこと55)、aSMaseと至適pHが中性領域であるneutral SMase(nSMase)とは腫瘍壊死因子TNFシグナル伝達において別々の役割を担っていること56)、なども報告された。1993年には、培地に加えた短鎖セラミドが細胞死を誘導することの発見により細胞死シグナル因子としてのセラミドというコンセプトが生まれた57)。その後、セラミドがstress-activated kinase(SAPK/JNK)の活性化を通じてアポトーシスを誘導するとした報告などがあり58, 59)、細胞死を誘導するセラミドを抗がん目的に利用する試みもされるようになってきた60, 61)。また、植物個体レベルにおいてもセラミドは細胞死シグナル因子として働く62)。
このような経緯により、セラミドは生合成の中間体というよりも細胞内メディエータ分子として注目されるようになってきた。それまではスフィンゴ脂質の研究といえば、スフィンゴ糖脂質蓄積症やガン化との関係で糖鎖といった複雑で多様な構造を有した極性頭部の役割に注目する研究が主体であったのだが6, 63)、相対的に単純な構造であり、通常は膜に中に埋まっていて細胞外や細胞質タンパク質と相互作用することもないであろうと半ば無視されていた感のあるセラミドそのものが90年代になるとスフィンゴ脂質研究の中心舞台へと躍り出てきたのである。
刺激に応じてセラミドを生産させる酵素として当初注目されたのはMg2+-依存性のnSMaseである。この活性は主に形質膜に局在することから細胞外刺激に応じて形質膜のSMを分解して情報伝達分子セラミドを作る責任酵素と期待されていた。哺乳動物nSMaseのcDNAは、細菌SMaseとのアミノ酸配列類似性からStoffelらのグループがクローニングし64)、次いでそのアイソフォームも同定した65, 66)。しかし、これら二種類のnSMaseの二重遺伝子破壊マウスは、野生型に比べて体が小さいながらもほぼ正常に生育し、細胞死経路や他の情報伝達系に顕著な異常は示さないと報告された64, 66)。Mg2+-依存性のnSMaseであるnSMase2(遺伝子名はSMPD3)はホスファチジルセリン(phosphatidylserine; PS)の共存で活性化される65)。nSMase2の触媒部位の結晶化解析が最近報告され、触媒部位のN端側にある膜近傍領域にPSが結合すると内在性の阻害部位が触媒部位から外れて活性型構造に変換するというモデルが提唱された67)。
細胞死の抑制効果はむしろaSMaseの遺伝子の破壊をした時に見られた68, 69)。aSMaseをコードするゲノム遺伝子は、細胞外に分泌されてZn2+で活性化するSMaseもスプライシング異性体としてコードしている70, 71)。よって、この二種類のSMaseのどちらか、もしくは両方が細胞死経路で働くセラミド生産に関与すると思われる。また、分解経路だけでなく小胞体で合成されるセラミドの蓄積が細胞死シグナルとなることもわかってきた72, 73)。
哺乳動物由来で至適pHが中性領域のセラミダーゼ(neutral ceramidase; nCERase)に関しては、九大の伊東らが酵素精製を通じて二種類のnCERaseのcDNAクローニングに成功した74, 75)。ほぼ同時期にHannunらによりヒトのミトコンドリア型nCERaseのcDNAが報告されたものの76)、この報告の結論には伊東グループから異論も提出されている77)。中性セラミダーゼの一次配列は、細菌から植物、無脊椎動物、ヒトに至るまでその遺伝情報が高度に保存されている78)。食餌由来スフィンゴ脂質を小腸でスフィンゴシンと脂肪酸に分解して栄養素として利用するためにnCERaseは必須であることが米国のProiaらによるAsah2欠失マウスの解析から判明した79)。
アルカリ性セラミダーゼ遺伝子は酵母の遺伝学的解析から同定され80)、ヒトゲノムは三種類のアルカリ性セラミダーゼをコードしていることが分かってきた(遺伝子名は、ACER1(別名ASAH3)、ACER2およびACER3)81)。さまざまな生理的役割が中性セラミダーゼやアルカリ性セラミダーゼにも示唆されているものの82)、これらセラミダーゼの情報伝達制御への明確な関与は証明されていない。
5.結合したセラミドにより直接制御されるタンパク質
セラミドの代謝に直接関与するタンパク質群(セラミダーゼ、SMS、GlcCer合成酵素、CERTなど)でさえ、基質結合様式が原子レベルで明らかにされているものはセラミドとの共結晶解析に成功したヒトCERT由来セラミド結合ドメインと細菌セラミダーゼにすぎない83, 84)。セラミドが情報伝達の制御分子であることを支持する報告は数多くあるが、セラミドが直接結合する実体が明確になっている例は限られており、結合機序が原子レベルで解明されている例はまだ皆無である(「まだ皆無」との説明は本稿オリジナル原稿脱稿時の2019年時点のことであり、セラミド研究会Webサイトに一部改訂して転載した2023年時点では、後述するようにセラミドによるSPT活性抑制機序が原子レベルで明らかにされている)。本稿では、セラミドが直接活性を制御していることがほぼ明らかにされているタンパク質を羅列的に紹介する。網羅的な紹介ではなく、セラミドといっても短鎖セラミドでの影響しか調べられていない場合や、実際にセラミドが結合することは未証明のタンパク質もあることは予めお断りしておく。
セラミドで直接活性制御される実体が明らかにされた最初はタンパク質脱リン酸化酵素PP2Aであろう。PP2Aは三つの異なるサブユニットから成っており、出芽酵母のPP2Aは、TPD3, CDC55, SIT4遺伝子産物から構成されている。NickelsとBroachは、出芽酵母PP2Aホモログがセラミドで活性化されるだけでなく、セラミドによる生育のG1停止がPP2Aサブユニット遺伝子上の変異で解除されることを発見した85)。その後、Hannunらは短鎖セラミドの添加で活性化される脱リン酸化酵素を精製してPP2Aであると同定し86)、さらに、制御サブユニットの存在がPP2Aのセラミド応答に必須であることや、短鎖ジヒドロセラミドは逆に抑制的に働くことを報告した87)。よって、セラミドによるPP2A活性化は幅広い生物種で保存されていると考えられる。なお、タンパク質脱リン酸化酵素PP-1もセラミドで活性化されるがホスファチジン酸(PA)では阻害され、一方、PP2AはPAでも活性化する88, 89)。
米国のOgretmenらは、ヒト肺胞基底上皮腺癌A549細胞破砕液にビオチン化C6-セラミドを混ぜてアビジン結合樹脂で回収する方法により、PP2A活性化機構の内在性阻害因子SET(別名inhibitor 2 of PP2A; I2PP2A, またはTAF-1b)にセラミドが結合することを見出し、セラミドによるPP2A活性化機構にはセラミドがSETの働きを抑止し、その結果としてPP2Aが活性化する分子機序もあることを示した90)。
受容体型チロシンキナーゼを介した細胞増殖シグナル経路において活性型Ras-GTPaseとリン酸化型Raf-1キナーゼとの会合は重要なイベントである。Raf-1キナーゼをリン酸化して活性化するキナーゼとして米国のKolesnickらにより報告されたceramide-activated kinaseの実体は、kinase suppressor of Ras(KSR)であることが判明している91)。また、Ca2+およびDAG結合活性を持たない非定型PKCの一つであるPKCzがセラミドで活性化することをスペインのMoscatらおよびドイツのMüllerらが見出している92, 93)。さらに、mitogen-activated protein kinase kinase kinase (MAPKKK)ファミリーの一つであるmixed lineage kinase 3(MLK3)もセラミドで直接活性化されると米国のRanaらが報告している94)。よって、セラミドによって直接活性化されるceramide-activated kinasesには少なくとも三種類の異なるキナーゼが含まれる。
低分子量GTP結合タンパク質および典型的PKCに依存して活性化されるホスホリパーゼD(細胞内では主にPCを分解していると考えられている)に対してセラミドが阻害的に働くことを米国のObeidらやカナダのBrindleyらが1990年代中盤に報告した95, 96)。
セラミドがミトコンドリアを介する細胞死を導くことは2000年代当初から知られていたがその機序は長らく不明であった(次節も参照)。欧州の複数のグループは、ポーリン様の構造を持つミトコンドリア外膜タンパク質VDAC1およびVDAC2が光励起性セラミド類似体で標識されたことをきっかけにして、セラミド誘導性の細胞死の実行因子はVDAC2であること示した97)。
p53は、細胞周期や細胞死を制御することから、特に細胞の癌化において注目されているタンパク質である。米国のKrupenkoらは、C16-セラミドでp53が安定化されるが他のアシル鎖長さのセラミドにはこの作用は見受けられないことを見出し、特定のセラミド分子種がp53の安定性制御リガンドとなっていると提唱している98)。
多くの膜タンパク質の膜内トポロジーは、当該タンパク質の最初の膜貫通ドメインが新合成の際に小胞体膜中に挿入される向きに大きく影響され、この向きはトランスロコン装置にどのように認識されるかで決まる。米国のYeらは、トランスロコンの会合分子の一つであるtranslocating chain-associated membrane protein 2(TRAM2)がセラミドおよびジヒドロセラミドにより活性阻害をうけ、その結果、GTP結合タンパク質共役型受容体(G-protein coupled receptor ; GPCR)の一種であるケモカイン受容体を含むいくつかの膜タンパク質のトポロジーが新合成の時に反転すること、そして、この現象が起きるには膜タンパク質の最初の膜貫通ドメインにGXXXNというアミノ酸モチーフが必要であることを見出した99, 100)。三つのTRAMアイソフォーム(TRAM1, TRAM1L, TRAM2)の全てには、TRAM/LAG1/CLN8 homology(TLC)ドメインが存在しており、このTLCドメインはセラミド合成酵素にも見出されていることからセラミド・ジヒドロセラミド認識ドメインでないかとも提唱されているが101)、TRAMのTLCドメインに実際にセラミドが結合するのかは不明である。
小胞体膜タンパクをコードする遺伝子である酵母ORM(二つのパラログORM1,2が存在する)やその哺乳類ホモログORMDL(三つのパラログORMDL1~3が存在する)は102)、小児喘息とヒトORMDL3近辺の一塩基多型に起因すると思われるORMDL3転写亢進の間に連関が見つかり注目され始めた103)。米国のWeissmanらは、酵母orm欠損株を用いた遺伝的相互作用解析の結果をヒントに、OrmはSPTと複合体を形成してSPT活性を負に制御すること、およびN末端領域がリン酸化したOrmはSPTと複合体を形成できなくなることを示し、さらに、セラミドなどスフィンゴ脂質生合成中間体がORMを介したSPT抑制シグナルになっていることも示唆した104)。その後、米国のWattenbergらは、酵母Ormでリン酸化を受けるN末端配列が哺乳類ORMDLsにはないことを指摘しつつ、哺乳類細胞では細胞に短鎖セラミドを与えるとORMDL依存性SPT抑制が発動することを示した105)。このような背景の元、2023年になって、中国のGongらは、ヒトSPT(SPTLC1とSPTLC2とのヘテロ二量体)とORMDL3との複合体にセラミドが結合している三次元構造を決定し、ORMDL3の特定領域にセラミドが結合するとはSPT部分へのアシルCoA侵入が妨げられることで酵素活性が抑制されること、さらに、小児性筋萎縮性側索硬化症と連関するSPTLC1変異の多くでセラミド・ORMDL3依存性SPT活性抑制機序が効かなくなることを明らかにした106)。なお、ORMDL3転写の亢進が喘息のリスク因子となる機序は2023年時点でも判然としていない。
Sph1Pに関しては、生理的な機能を発揮するのに相応しい濃度でヒト血中に存在することや、特異的なGPCRを介して働くといった発見が我が国の矢冨、五十嵐、多久和らの研究などを始めとして90年代後半から積みあがり107-109)、その生理的脂質メディエータとしての重要性はもはや疑うべくもない。一方、セラミドをリガンドとするGPCRが見出されていないためか、細胞内で生み出される天然型セラミドが本当に脂質メディエータとして機能しているのかに関してはまだ疑いの目もあろうかと思われる。セラミドを結合して活性が変化するタンパク質群を同定したうえで、当該タンパク質の機能がセラミドで制御される機序を原子レベルで解明し、さらにその制御の生理的な意義も明らかにするような努力が今後も必要である。
6.セラミドのリン脂質膜への直接作用
セラミドは、複合スフィンゴ脂質と違い極性頭部がなく、DAGに比較してアシル部分の飽和度が高いという化学構造上の特徴を持つため、リン脂質二重層のセラミド量の多少の変化が膜の状態に大きな影響を与えうる110, 111)。よって、タンパク質との相互作用を介せずに発揮できるセラミドの生物学的機能というものも存在する可能性がある。例えば、膜中のセラミド量が増えると膜融合や膜小胞出芽を誘導することが知られており112, 113)、このセラミドの性質は、筋細胞などで形質膜に損傷があった場合に損傷部位をカベオラcaveolaeとともにエンドサイトーシスして除去修復する事象とも関係しているかもしれない114)。nSMaseによってSMが分解されてエンドソーム中のセラミド濃度が高くなると膜が陥没して内腔小胞(それはエキソソームとして細胞外に放出されると考えられている)が形成されるが115)、そのような内腔小胞形成作用はジヒドロセラミドにはない116)、と示唆されている。小胞体で合成されたセラミドがCERTを介してエンドソームに供給されることでも内腔小胞の形成は促進される117-119)。
ミトコンドリアにターゲットするような細菌SMase組換え体を乳がん由来MCF7細胞に発現すると細胞死を引き起こすとObeidらが報告し120)、さらに、単離したミトコンドリアにセラミドを加えるとその外膜においてシトクロームcが透過できるような小孔を形成する(一方、ジヒドロセラミドでは小孔は形成されない)ことを米国のColombiniらが報告した121)。ただし、上述したようにVDAC2を実行因子とする経路が示されたことで、内在性セラミド自体がミトコンドリア外膜に穴を開けるとするモデルには懐疑的な向きもある。
7.皮膚の主要構成成分としてのセラミド
哺乳動物では皮膚特異的な構造をしたいろいろなセラミド分子種が豊富に存在し、それらは皮膚のバリア機能、特に保湿のためのバリア機能に重要な役割を担っている122, 123)。皮膚セラミドの代謝を担う遺伝子群は長らく不明であったが、皮膚セラミドに含まれる極長鎖脂肪酸の代謝酵素群も含めて、北大の木原らが網羅的ともいえる解明を成し遂げつつある124)。その詳細は本研究会Webサイト中の総説『表皮セラミドによる透過性バリア形成』を参照されたい。
質量分析により脂質分子を解析することは20世紀中から行われていたが、質量分析機器の機能向上に伴い21世紀になると生体から得られた脂質分子種を網羅的に解析するリピドミクスが本格的に始動し、質量分析データをバンク化して公的に提供する活動も行われるようになった(日本のLipid Bank, http://lipidbank.jp/ や米国の LIPID MAPS, http://www.lipidmaps.org/)。リピドミクスは、今や脂質全般の研究になくてはならない手法となっており、皮膚セラミドの研究展開においても花王の研究グループの開発した超高感度セラミド分子種解析法が役立っている125)。
昨今、化粧品や石鹸などといった日用品にセラミドという言葉が伴うようになってきたため、ごく一般の人でもセラミドという言葉だけは知っている(聞いたことがある)という状況になっている。そして、外用品にとどまらず、セラミドもしくはその関連物質(特に植物由来のグルコシルセラミド)を飲食物に添加し、機能性食品として市販することも現実化している。美容や健康のための外用品や食品としてのセラミドを利用する研究もセラミド研究会の主要なテーマとなっている。
8.脂質ラフト説の登場
コレステロールとスフィンゴ脂質とが相互作用して形成する膜脂質微小ドメイン、すなわち脂質ラフト(lipid rafts)という概念の登場は、スフィンゴ脂質だけでなく脂質全般の研究に多大な影響を与えた。20世紀の終盤は、発生や分化といった複雑な生命現象を分子レベルで解き明かすことが最先端の生命科学研究と見なされていた時代であり、その中で脂質学はなかなか注目されにくい研究分野であった。しかし、脂質の物理化学的性質に駆動されて形成される機能的な膜微小ドメインという概念は、幅広い分野の研究者の興味の対象となり、1990年初頭から現在に至るまでラフトに関する様々な研究が繰り広げられている126, 127)。それに伴い、脂質ラフトの主要構成因子であるスフィンゴ脂質もコレステロール並みに多くの研究者に知られるようになってきたわけである。
本稿では脂質ラフト説の登場に大きく貢献した代表論文のみ紹介する。1988年にドイツのSimonsとvan Meerは、極性細胞のゴルジ体においてスフィンゴ糖脂質が集積する微小ドメインができ、それとの相互作用の違いによりタンパク質の選別が起こると想定したモデルを提唱した128)。これが脂質ラフトの原点と考えられている。しかし、このモデルではスフィンゴ糖脂質の役割は強調されているもののSMやコレステロールが寄与する必然性は特にない。現在の一般的な脂質ラフトの説明は、(1)グリセロ脂質に比べてアシル構造が飽和型であるスフィンゴ脂質がコレステロールと分子レベルで密接に接触し、さらに、(2)水酸基一つだけしか親水性基のないコレステロールが脂質二重層中に安定して存在するために周辺の複合脂質の極性頭部が傘のように覆いかぶさる(アンブレラ効果と呼ばれる)という二つタイプの駆動力でスフィンゴ脂質・コレステロールが濃縮した膜微小ドメインが形成される、というものである。この現行モデルを導いた端緒は、米国のBrownとRoseが1992年に出した論文にあると思われる129)。当該論文において、極性細胞をマイルドな界面活性剤Triton X-100で低温処理した後に得られるTriton X-100耐性膜小胞には、頂端膜apical membraneに輸送されるGPI-アンカータンパク質だけでなく、飽和脂肪酸を付加した膜タンパク質群、そしてスフィンゴ糖脂質やSMさらにコレステロールが濃縮して回収されることを見出し、これがSimonsらのいうラフトの生化学的実体であろうと提唱したのである。さらに、人工膜の系においてTriton X-100耐性膜の形成には飽和型アシル基の存在が重要であることや130)、スフィンゴ糖脂質を欠いた細胞からでもTriton X-100耐性膜は分離できること131)、などもBrownらは示した。無傷細胞膜上に存在する脂質ラフトと生化学的に分離したTriton X-100耐性膜とを同一視できないこともやがて判明してきたが、脂質ラフトの性質が部分的にはTriton X-100耐性膜にも反映されていると考えられている。
人工脂質膜の実験系において、セラミドはコレステロールを脂質ラフトから追い出すことが示されている132)。上述したようにコレステロール分子に密着しやすい化学構造上の特性はセラミド部分にあるのだが、セラミド部位だけでは極性頭部を欠くためアンブレラ効果を発揮できない。そして、セラミドが脂質二重層中に安定に存在するにはコレステロールと同様に周辺脂質のアンブレラ効果が必要であり、コレステロールとセラミドは傘となる複合スフィンゴ脂質を脂質ラフトにおいて競合して取り合うと解釈されている。
9.セラミド代謝の阻害剤:
低分子阻害剤は、様々な生命科学分野において有用なツールであり、時として疾病治療薬へと発展する。スフィンゴ脂質代謝に関わる様々なステップに対する阻害剤が現在では知られているが、その網羅的記載は別の総説を参照していただき133, 134)、本稿では、セラミドの合成および分解、もしくはセラミドからSMやGlcCerに変換するステップの阻害剤に絞り、パイオニア的な事例を振り返る。
スフィンゴ脂質合成の初発酵素SPTの特異的な阻害剤は、セラミドに限らずスフィンゴ脂質全般の研究に重要な薬剤ツールである。SPT阻害剤としての発見はスフィンゴファンギン類sphingofunginsのほうが早いが135)、ここでは医薬に結びついた経緯を含めてミリオシンmyriocin/ISP-1について簡単に述べる。ミリオシンは子嚢菌Myriococcum albomycesから抗真菌活性のある物質としてカナダのグループが単離し136)、一方、ISP-1はインターロイキン2依存性マウス細胞障害性T細胞の増殖を抑制する物質としてセミに寄生するカビIsaria sinclairii(冬虫夏草として知られている)から京大の藤多らが単離した137)。そして、化学構造的に同一であるミリオシン/ISP-1はSPTを強く阻害することを京大の川嵜・小堤らが見出した(小堤からの私信によれば、ISP-1の化学構造がスフィンゴ脂質と類似しているので直感的に思いついたとのことである)138)。スフィンゴファンギン類やミリオシン/ISP-1は、疑似反応中間体の形でSPT酵素に結合することで強力かつ特異性の高い阻害活性を発揮している7, 139, 140)。なお、ISP-1がマウス個体で示した免疫抑制活性はSPT阻害能のない類縁体にもあることが見出され141)、リン酸化されたのちにSph1P受容体アゴニストとして働く免疫抑制剤FTY720(別名フィンゴリモドFingolimod)が誕生した142-145)。
カビ毒フモニシンfumonisin B1がジヒドロスフィンゴシンN-アシル転移酵素(dihydrosphingosine-N-acyltransferase;現在ではセラミド合成酵素ceramide synthaseとの呼び名が一般的である)を阻害することを米国のMerrillらは見出した13)。フモニシンB1の発見は、ジヒドロスフィンゴシンがN-アシル化されてジヒドロセラミドになった後に不飽和化されてセラミドとなるという合成経路の確立にも大きく貢献した。セラミド分解酵素に関して、セラミド類似構造を有する化合物N-oleoylethanolamineおよび (1S,2R)-D-erythro-2-(N-myristoylamino)-1-phenyl-1-propanol(D-e-MAPP)は、それぞれ酸性セラミダーゼおよびアルカリ性セラミダーゼを阻害すると報告されている146, 147)。これら初期のセラミダーゼ阻害剤は全てセラミド類似の構造をしているが、セラミド類似構造を持たない阻害剤Ceranib-2がその後開発され、そのマウス投与時に乳腺癌増殖の遅延効果があることも報告されている148)。
セラミドからGlcCerへの変換を担うGlcCer合成酵素の選択的阻害剤は、Radinらの開発によるD-threo-1-phenyl-2-denanoylamino-3-morpholino-1-propanol(PDMP)が嚆矢である149)。Plattらの開発したGlcCer合成酵素阻害剤N-butyldeoxynojirimycin (別名ミグルスタットMiglustat)も汎用されており150)、ミグルスタットはゴーシェ病やニーマン・ピック病C型の治療薬として使用されるようになった。
一方、セラミドからSMへの代謝を担うSM合成酵素(SMS)の阻害剤としてtricyclodecan-9-yl-xanthogenate (D609)が利用されているが、PC特異的ホスホリパーゼC阻害剤としてもみなされているD609の標的特異性はいまだに不明瞭である。最近、SMS2に選択性の高い阻害剤が報告された151, 152)。また、酵素ではないが、セラミドを小胞体からゴルジ体のSM合成の場に運ぶ脂質転送タンパク質CERTに対する特異性の高い阻害剤として、セラミドに似た化学構造を持つ (1R,3S)- N-(3-hydroxy-1-hydroxymethyl-3-phenylpropyl)dodecanamide(HPA-12)とセラミド類似構造を持たない4′-(2-hydroxyethanesulfonyl)-4-pentyl-3-(2-(pyridin-2-yl)-(1S, 2R)-cyclopropyl)-1,1′-biphenyl(HPCB-5:別名E16A)という二つのタイプが開発されている153, 154)。
セラミドの代謝に関わる複数の代謝阻害剤が揃うことでセラミド研究は促進されてきた。例えば、フモニシンB1でセラミド合成を阻害したときに起こる細胞の性状変化の原因がセラミド量減少のためなのか前駆体ジヒドロスフィンゴシン蓄積のためなのかを区別したい場合、ジヒドロスフィンゴシン蓄積を起こさずにセラミド量を減少させるSPT阻害剤処理でも同じ性状変化が起こるかどうかを調べればよい。ただし、阻害剤を実験で使う際には常にオフターゲットの問題があることを忘れてはならない。例えば、PDMPはGlcCer合成阻害以外にもセリン・トレオニンキナーゼの一種であるmTORC1(mammalian target of rapamycin complex 1)の細胞内分布を変化させて当該キナーゼ機能を阻害する155)。
10.セラミド研究史を飾るその他の重要ツール
セラミドの研究を展開する上で重要な研究ツールが阻害剤以外にもいろいろと存在する。その中のカテゴリーの一つが、脂質認識プローブである。抗セラミド抗体にはIgM型とIgG型の二タイプが報告されていて、どちらもフローサイトメトリー解析や免疫染色細胞化学解析に使えるとされているが156, 157)、米国のBieberichらの開発した抗セラミド・ポリクローナルIgG抗体は細胞中のオルガネラ染色にも適用できると報告されている157)。志賀毒素(別名ベロ毒素)とコレラ毒素は、それぞれグロボシルセラミドGb3とガングリオシドGM1を特異的な膜受容体としており158, 159)、これら毒素の受容体結合サブユニットは生細胞表面のGb3やGM1の特異的認識プローブとして利用されている。名大の古川らはGb3合成酵素を欠損したマウスは志賀毒素に完全に耐性になることを示し、当該毒素受容体の特異性を動物個体レベルで明確にした160)。シマミミズの体腔液から見出した細胞溶解性毒素・ライセニンはSMを特異的な膜受容体として認識することを都臨床研の梅田らは明らかにし161)、その後、生きた細胞上でのSM認識プローブとして利用できるようにSM結合性は維持しつつ細胞溶解性を低減したライセニン改変体を理研の小林らは開発した162)。
第二のカテゴリーは蛍光性脂質である。米国のPaganoらは、短鎖NBDでN-アシル化したセラミドすなわちC6-NBDセラミドを作製し、これを低温条件下にて培地に加えると細胞に取り込まれて小胞体に分布し、そこから37℃に温めると核周辺のゴルジ体領域に蛍光は移行するとともにGlcCerやSMへと代謝されることや163)、ホスファチジルエタノールアミンのC6-NBD標識体はセラミドとは全く異なる細胞内挙動をすることを見出した164)。Paganoらの研究を端緒として様々な蛍光性脂質類似体が開発され、細胞内の脂質の動態や選別輸送の解析における重要ツールとして汎用されている(蛍光脂質類似体の多くは、Avanti Polar Lipids社や旧Molecular Probes社を買収したThermo Fisher Scientific社から購入可能)。
第三のカテゴリーとしては特異的な突然変異を有する細胞や動物が挙げられる。遺伝性リピドーシス患者に由来する細胞を不死化した培養細胞は今でも重要な研究ツールである。また、出芽酵母の様々なスフィンゴ脂質代謝欠損変異株はもとより、マウスメラノーマ由来B16細胞のGlcCer合成活性欠損変異株GM-95 165)、チャイニーズハムスター卵巣由来CHO細胞のSPT活性欠損変異株LY-B166)、細胞内セラミド輸送活性の欠損した変異株LY-Aなどは167)、それぞれに欠損した遺伝子の同定に利用されただけでなく、スフィンゴ脂質欠損モデル細胞として広く利用されてきた(ちなみにLY-A、LY-B株ともにライセニン耐性CHO細胞変異株として分離された166))。以前は多大な労力を払って分離した哺乳動物細胞変異株であったが、2010年代に入って登場したゲノム編集技術を活用することで簡便に得られるようになった。変異マウスも重要なツールであり、先述したリピドーシスのモデルマウスをはじめとしてセラミド代謝関連遺伝子ノックアウト動物が数多く作製されて研究に供されてきた168, 169)。
上記のどのカテゴリーにも属しないがglycosphingolipid ceramide N-deacylase(SCDase)も重要なツールである。スフィンゴ糖脂質のセラミド部分の脱アシル化を触媒する酵素・SCDaseは放線菌の一種であるNocardia菌から最初に見いだされたのだが170)、グラム陰性好気性桿菌であるPseudomonas菌から精製されたSCDaseを用いた解析から、本酵素は同位体標識や蛍光標識した様々なセラミド分子種を自家調整する目的にも活用できることが示された171)。長鎖塩基および様々なタイプの脂肪酸とSCDaseとを界面活性剤Triton X-100存在下で混ぜると脱アシル化の逆反応によりセラミドが生成し、できたセラミドは水不溶性物質として随時Triton X-100ミセル相へ移行するため、全体としてセラミド合成の方向に反応が進むのである。
11.デオキシスフィンゴ脂質について
近年進展著しいリピドミクス解析の高度化に伴い、従来は検出不可能であったような極微量脂質の存在がセラミド関連分子に関しても分かり出しており、そのなかでも特に注目を集めているのが1-デオキシスフィンゴ脂質(1-deoxysphingolipids; deoxySLs)である(図4)。
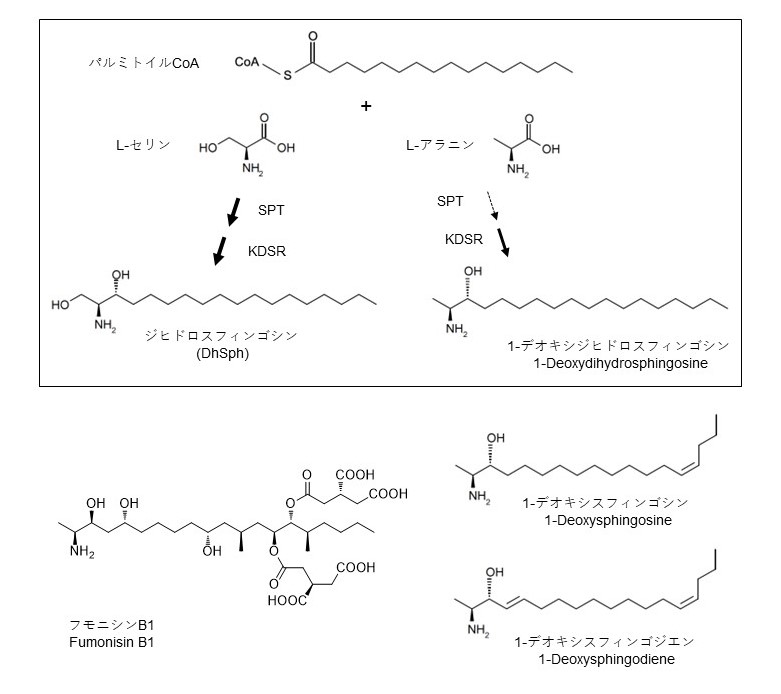
図4 天然に見出されるデオキシスフィンゴ脂質
生体膜成分のスフィンゴ脂質群は、共通に1,3-diolを持つ長鎖塩基を有しているが、カビ毒フモニシンB1のように長鎖塩基のC1位の水酸基が欠けている1-デオキシ体 (1-deoxy, 3-ol)も天然には存在する。質量分析の結果、ヒト組織においてもdeoxySLsが存在するとの報告が2009年にされた。Merrillらは、フモニシンB1によりセラミド合成を阻害すると、新たなスフィンゴ脂質代謝産物として1-deoxy dihydrosphingosine(deoxyDhSph)、1-deoxy dihydroceramideが生産されることを見出した。一方、スイスのHornemannらは、遺伝性感覚性自律神経性ニューロパチー(hereditary sensory and autonomic neuropathy, HSAN1)患者の組織からdeoxySLsを見出した。HSAN1症状は、スフィンゴ脂質合成の初発酵素SPTのサブユニットSPTLC1もしくはSPTLC2のアミノ酸置換型変異によりdominant(従来は優性と和訳されていたが、現在、顕性にすべき等の議論がある)に現れる172-174)。SPTサブユニットの欠失型変異ではなく特定のアミノ酸置換変異においてdominantに現れるというHSAN1の遺伝的特性は、変異型SPTにより合成されたdeoxySLsが神経毒性を発揮すると考えれば説明できる。また、正常なSPTからでも細胞中のセリンが欠乏するとdeoxySLsが合成される。もともとはセリンへの親和性が高いSPTではあるが、そのセリン選択性が下がる変異が起こった場合や細胞内セリンが枯渇するような条件下ではセリンの代わりにアラニンあるいはグリシンとパルミトイルCoAを縮合して1-デオキシ型の長鎖塩基を合成してしまうのである(図4)。
血清中deoxySLsレベルが糖代謝の異常な肥満・糖尿病患者では高い175)。deoxySLsは、特に神経細胞に強い毒性を示すが、その作用機構としてミトコンドリア機能への影響が考えられている176)。正常な細胞、脳組織からもデオキシ体は微量ながら検出されるので、細胞毒性とは異なる何らかの生理作用がある可能性は否定できない。また、分子量的に1−デオキシスフィンゴシンと思われていた代謝産物が、その二重結合の位置が通常と異なっており、14Zであることも判明した177)。deoxyDhSphは、ジヒドロスフィンゴシンとは異なる経路で不飽和化されるらしい。質量分析だけで構造を議論するオミックス研究に警鐘を鳴らす事例である。
12.おわりに
その発見から100年以上を経て、セラミドの構造や代謝経路、そしてその機能に関して多くの知見が蓄積し、その知見を医療だけでなく健康・美容の維持に応用しようとする機運も高まっている。ごく最近になり見出されたdeoxySLsのようにその病理的、生理的な意味が不明なセラミド関連分子も存在し、また、現時点で未知なセラミド関連分子がこれからもさらに発見されるであろう。ヒト個体において見出される微量で新規な脂質はヒト細胞が自前で合成するだけの分子にとどまらず、食事または腸内細菌から由来するセラミド関連分子が人間に対して重要な生理的意味を持つ可能性も視野に入れておきたい。成人一人の人間には、腸内を筆頭に口腔内や皮膚表面などで総計600~1000兆個の微生物(マイクロバイオータ)と共存しており、これら微生物が生み出す代謝産物の一部は脳血液関門を貫通して脳の機能に影響を及ぼすことが次第に明らかにされつつある。そして、セラミドを医薬品・、医薬部外品や食品などに利用する際には、その有効性および安全性に関しての厳密な検証はもとより、その作用機序の詳細な説明が今後ますます求められるであろう。
付記
本コンテンツは、セラミド研究会が編集した『セラミド研究の新展開~基礎から応用へ~』(発行日,2019年6月1日;発行者,株式会社・食品化学新聞社)に上梓した総説を一部内容改変して本研究会Webサイトに転載するものです(2023年7月19日)。本コンテンツの著作権は食品化学新聞社に帰属しており、セラミド研究会は転載することの承認を食品化学新聞社から得ています。
本コンテンツの改訂履歴
2024年4月30日:著者の所属部署名の改称;「イノシトールホスホリルセラミド」を「イノシトールホスホセラミド」に、「細胞膜」を「形質膜に」それぞれ語句変更;本研究会Webサイト学術コンテンツへのリンク追加;CERT新阻害剤の追記;セラミド初出文献の訂正。
本コンテンツは、クリエイティブ・コモンズ の定めたCC BY 4.0ライセンスの条件で掲載しており、著者と著作権所有者が明記され、かつ、日本セラミド研究会からの出版物である旨が引用されていることを条件として、他の会での使用、配布、または複製は許可されています。これらの条件に準拠していない使用,配布,または複製は許可されていません。
CC BY 4.0ライセンスの内容については以下URLを参照してください。
https://creativecommons.org/licenses/by/4.0/
図の説明
図1 哺乳動物における主たるセラミド関連分子の化学構造
天然型スフィンゴシンの図示したような立体化学構造、すなわち、D-erythro-スフィンゴシンである。図示したスフィンゴシン、ジヒドロスフィンンゴシン、フィトスフィンンゴシンをIUPAC(International Union of Pure and Applied Chemistry)命名法で書き記せば、それぞれ、(2S,3R,4E)-2-amino-4-octadecene-1,3-diol、(2S,3R)-2-amino-octadecane-1,3-diol、(2S,3R,4R)-2-amino-octadecane-1,3,4-triolとなる。図中のセラミドおよび複合スフィンゴ脂質のアシル基は炭素鎖長16のパルミトイル基に統一しているが、実際には様々な鎖長のアシル基が存在する。また、GalCerのアミドアシル基のC2位(α位)は水酸化されている場合が多い。
図2 セラミド関連分子の生合成経路
酵素名の下に斜体で遺伝子名を記載した。同様の反応を担う複数の酵素がある場合はそれらの遺伝子名は”or または~”で結び、一方、一つの酵素が異なるサブユニットから成る場合はそれら遺伝子名を”+”で結んだ。A. 出芽酵母細胞における生合成経路. 出芽酵母においては、セラミドのアシル鎖はα位に水酸基のあるC26脂肪酸が主体であり、このα水酸化反応はSCS7遺伝子産物が担う。また、イノシトールホスホセラミド(inositol phosphoceramide; IPC)のセラミド構造は通常フィトセラミドである。B. ヒト細胞における生合成経路. なお、基質の移動に関与する因子は図中に記載されていないが、SM合成の際にはセラミドを小胞体からゴルジ体へと運ぶ脂質輸送タンパク質CERTが、GalCer合成の際にはUDP-ガラクトースをサイトソルから小胞体内側へ運ぶ輸送体がそれぞれ必要である。
図3 ヒト細胞におけるセラミド関連分子の分解経路
記載法は図2に準じている。図では酵素のみを取り挙げているがリソソームにおけるスフィンゴ糖脂質の分解には補助因子としてサポシン類が必要である(本文参照)。
図4 天然に見出されるデオキシスフィンゴ脂質
SPTがセリンの代わりにアラニンやグリシンを利用すると末端の水酸基がない1-デオキシ長鎖塩基が生成される。1-デオキシ長鎖塩基は天然のスフィンゴシンとは異なる位置にシス配置の二重結合をもつように代謝される。なお、カビの生産するマイコトキシンFB1の生合成経路は不明だが1-デオキシ長鎖塩基に類似する構造を内部に持っている。
引用文献
1) 山川民夫 糖脂質物語. (講談社, 東京; 昭和56年).
2) Sourkes TL: The discovery of lecithin, the first phospholipid. Bull Hist Chem 29, 9-15 (2004)
3) Thudichum JLW A treatise on the chemical constitution of the brain. (Bailliere, Tindall, and Cox, London; 1884).
4) Fränkel E & Bielschowsky F: Untersuchungen über die Lipoide der Säugetierleber. II. Mitteilung. Über das Vorkommen des Lignoceryl-sphingosins in der Schweineleber. Hoppe-Seyler’s Z Physiol Chem (in Germany) 213, 58-62 (1932)
5) Carter HE & Greenwood FL: Biochemistry of the sphingolipides. VII. Structure of the cerebrosides. J Biol Chem 199, 283-288 (1952)
6) Hakomori S & Kanfer JN Spihngolipid Biochemistry. (Plenum Publishing, New York; 1983).
7) Hanada K: Serine palmitoyltransferase, a key enzyme of sphingolipid metabolism. Biochim Biophys Acta 1632, 16-30 (2003)
8) Braun PE & Snell EE: Biosynthesis of sphingolipid bases. II. Keto intermediates in synthesis of sphingosine and dihydrosphingosine by cell-free extracts of Hansenula ciferri. J Biol Chem 243, 3775-3783 (1968)
9) Stoffel W et al.: Biosynthesis of dihydrosphingosine in vitro. Hoppe Seylers Z Physiol Chem 349, 664-670 (1968)
10) Sribney M: Enzymatic synthesis of ceramide. Biochim Biophys Acta 125, 542-547 (1966)
11) Gatt S: Enzymic Hydrolysis and Synthesis of Ceramides. J Biol Chem 238, 3131-3133 (1963)
12) Novgorodov SA et al.: Novel pathway of ceramide production in mitochondria: thioesterase and neutral ceramidase produce ceramide from sphingosine and acyl-CoA. J Biol Chem 286, 25352-25362 (2011)
13) Merrill AH, Jr. et al.: Fumonisin B1 inhibits sphingosine (sphinganine) N-acyltransferase and de novo sphingolipid biosynthesis in cultured neurons in situ. J. Biol. Chem. 268, 27299-27306 (1993)
14) Buede R et al.: Cloning and characterization of LCB1, a Saccharomyces gene required for biosynthesis of the long-chain base component of sphingolipids. J Bacteriol 173, 4325-4332 (1991)
15) Pinto WJ et al.: Sphingolipid long-chain-base auxotrophs of Saccharomyces cerevisiae: genetics, physiology, and a method for their selection. J Bacteriol 174, 2565-2574 (1992)
16) Guillas I et al.: C26-CoA-dependent ceramide synthesis of Saccharomyces cerevisiae is operated by Lag1p and Lac1p. EMBO J 20, 2655-2665 (2001)
17) Schorling S et al.: Lag1p and Lac1p are essential for the Acyl-CoA-dependent ceramide synthase reaction in Saccharomyces cerevisae. Mol Biol Cell 12, 3417-3427 (2001)
18) Pewzner-Jung Y et al.: When do Lasses (longevity assurance genes) become CerS (ceramide synthases)?: Insights into the regulation of ceramide synthesis. J Biol Chem 281, 25001-25005 (2006)
19) Mizutani Y et al.: Ceramide biosynthesis in keratinocyte and its role in skin function. Biochimie 91, 784-790 (2009)
20) Vallee B & Riezman H: Lip1p: a novel subunit of acyl-CoA ceramide synthase. EMBO J 24, 730-741 (2005)
21) Wegner MS et al.: The enigma of ceramide synthase regulation in mammalian cells. Prog Lipid Res 63, 93-119 (2016)
22) Schulte S & Stoffel W: Ceramide UDPgalactosyltransferase from myelinating rat brain: purification, cloning, and expression. Proc Natl Acad Sci U S A 90, 10265-10269 (1993)
23) Ichikawa S et al.: Expression cloning of a cDNA for human ceramide glucosyltransferase that catalyzes the first glycosylation step of glycosphingolipid synthesis. Proc Natl Acad Sci U S A 93, 12654 (1996)
24) Hanada K et al.: Molecular machinery for non-vesicular trafficking of ceramide. Nature 426, 803-809 (2003)
25) Huitema K et al.: Identification of a family of animal sphingomyelin synthases. EMBO J 23, 33-44 (2004)
26) Yamaoka S et al.: Expression cloning of a human cDNA restoring sphingomyelin synthesis and cell growth in sphingomyelin synthase-defective lymphoid cells. J Biol Chem 279, 18688-18693 (2004)
27) Bajjalieh SM et al.: Synaptic vesicle ceramide kinase. A calcium-stimulated lipid kinase that co-purifies with brain synaptic vesicles. J Biol Chem 264, 14354-14360 (1989)
28) Sugiura M et al.: Ceramide kinase, a novel lipid kinase. Molecular cloning and functional characterization. J Biol Chem 277, 23294-23300 (2002)
29) Senkal CE et al.: Ceramide Is Metabolized to Acylceramide and Stored in Lipid Droplets. Cell Metab 25, 686-697 (2017)
30) Holland WL et al.: Inhibition of ceramide synthesis ameliorates glucocorticoid-, saturated-fat-, and obesity-induced insulin resistance. Cell Metab 5, 167-179 (2007)
31) Chaurasia B et al.: Targeting a ceramide double bond improves insulin resistance and hepatic steatosis. Science 365, 386-392 (2019)
32) Sugita M et al.: Ceramidase deficiency in Farber’s disease (lipogranulomatosis). Science 178, 1100-1102 (1972)
33) Patrick AD: A deficiency of glucocerebrosidase in gaucher’s disease. Biochemical J. 97, 17C-24C (1965)
34) Brady RO et al.: Metabolism of Glucocerebrosides. Ii. Evidence of an Enzymatic Deficiency in Gaucher’s Disease. Biochem Biophys Res Commun 18, 221-225 (1965)
35) Suzuki K & Suzuki Y: Globoid cell leucodystrophy (Krabbe’s disease): deficiency of galactocerebroside beta-galactosidase. Proc Natl Acad Sci U S A 66, 302-309 (1970)
36) Brady RO et al.: The metabolism of sphingomyelin. II. Evidence of an enzymatic deficiency in Niemann-Pick diseae. Proc Natl Acad Sci U S A 55, 366-369 (1966)
37) Li CM et al.: Insertional mutagenesis of the mouse acid ceramidase gene leads to early embryonic lethality in homozygotes and progressive lipid storage disease in heterozygotes. Genomics 79, 218-224 (2002)
38) Tybulewicz VL et al.: Animal model of Gaucher’s disease from targeted disruption of the mouse glucocerebrosidase gene. Nature 357, 407-410 (1992)
39) Kobayashi T et al.: The Twitcher mouse: an enzymatically authentic model of human globoid cell leukodystrophy (Krabbe disease). Brain Res 202, 479-483 (1980)
40) Horinouchi K et al.: Acid sphingomyelinase deficient mice: a model of types A and B Niemann-Pick disease. Nat Genet 10, 288-293 (1995)
41) Otterbach B & Stoffel W: Acid sphingomyelinase-deficient mice mimic the neurovisceral form of human lysosomal storage disease (Niemann-Pick disease). Cell 81, 1053-1061 (1995)
42) Platt FM et al.: The cell biology of disease: lysosomal storage disorders: the cellular impact of lysosomal dysfunction. J Cell Biol 199, 723-734 (2012)
43) Suzuki K: My encounters with Krabbe disease: A personal recollection of a 40-Year journey with young colleagues. J Neurosci Res 94, 965-972 (2016)
44) Li Y et al.: Genetic ablation of acid ceramidase in Krabbe disease confirms the psychosine hypothesis and identifies a new therapeutic target. Proc Natl Acad Sci U S A 116, 20097-20103 (2019)
45) Sandhoff R & Sandhoff K: Emerging concepts of ganglioside metabolism. FEBS Lett(2018)
46) Mehl E & Jatzkewitz H: [A cerebrosidesulfatase from swine kidney]. Hoppe Seylers Z Physiol Chem 339, 260-276 (1964)
47) Ho MW & O’Brien JS: Gaucher’s disease: deficiency of ‘acid’ -glucosidase and reconstitution of enzyme activity in vitro. Proc Natl Acad Sci U S A 68, 2810-2813 (1971)
48) O’Brien JS et al.: Coding of two sphingolipid activator proteins (SAP-1 and SAP-2) by same genetic locus. Science 241, 1098-1101 (1988)
49) Kishimoto Y et al.: Saposins: structure, function, distribution, and molecular genetics. J Lipid Res 33, 1255-1267 (1992)
50) Hannun YA & Bell RM: Lysosphingolipids inhibit protein kinase C: implications for the sphingolipidoses. Science 235, 670-674 (1987)
51) Hannun YA et al.: Sphingosine inhibition of agonist-dependent secretion and activation of human platelets implies that protein kinase C is a necessary and common event of the signal transduction pathways. J Biol Chem 262, 13620-13626 (1987)
52) Okazaki T et al.: Sphingomyelin turnover induced by vitamin D3 in HL-60 cells. Role in cell differentiation. J Biol Chem 264, 19076-19080 (1989)
53) Kiss Z et al.: Phorbol ester stimulation of sphingomyelin synthesis in human leukemic HL60 cells. Arch Biochem Biophys 265, 38-42 (1988)
54) Kolesnick RN: Thyrotropin-releasing hormone and phorbol esters stimulate sphingomyelin synthesis in GH3 pituitary cells. Evidence for involvement of protein kinase C. J Biol Chem 264, 11688-11692 (1989)
55) Venable ME et al.: Identification of a defect in the phospholipase D/diacylglycerol pathway in cellular senescence. J Biol Chem 269, 26040-26044 (1994)
56) Wiegmann K et al.: Functional dichotomy of neutral and acidic sphingomyelinases in tumor necrosis factor signaling. Cell 78, 1005-1015 (1994)
57) Obeid LM et al.: Programmed cell death induced by ceramide. Science 259, 1769-1771 (1993)
58) Westwick JK et al.: Ceramide activates the stress-activated protein kinases. J Biol Chem 270, 22689-22692 (1995)
59) Verheij M et al.: Requirement for ceramide-initiated SAPK/JNK signalling in stress-induced apoptosis. Nature 380, 75-79 (1996)
60) Stover TC et al.: Systemic delivery of liposomal short-chain ceramide limits solid tumor growth in murine models of breast adenocarcinoma. Clin Cancer Res 11, 3465-3474 (2005)
61) Morad SA & Cabot MC: Ceramide-orchestrated signalling in cancer cells. Nat Rev Cancer 13, 51-65 (2013)
62) Liang H et al.: Ceramides modulate programmed cell death in plants. Genes Dev 17, 2636-2641 (2003)
63) Hakomori S & Igarashi Y: Gangliosides and glycosphingolipids as modulators of cell growth, adhesion, and transmembrane signaling. Adv Lipid Res 25, 147-162 (1993)
64) Tomiuk S et al.: Cloned mammalian neutral sphingomyelinase: functions in sphingolipid signaling? Proc Natl Acad Sci U S A 95, 3638-3643 (1998)
65) Hofmann K et al.: Cloning and characterization of the mammalian brain-specific, Mg2+-dependent neutral sphingomyelinase. Proc Natl Acad Sci U S A 97, 5895-5900 (2000)
66) Stoffel W et al.: Neutral sphingomyelinase 2 (smpd3) in the control of postnatal growth and development. Proc Natl Acad Sci U S A 102, 4554-4559 (2005)
67) Airola MV et al.: Structure of human nSMase2 reveals an interdomain allosteric activation mechanism for ceramide generation. Proc Natl Acad Sci U S A 114, E5549-E5558 (2017)
68) Santana P et al.: Acid sphingomyelinase-deficient human lymphoblasts and mice are defective in radiation-induced apoptosis. Cell 86, 189-199 (1996)
69) De Maria R et al.: Acidic sphingomyelinase (ASM) is necessary for fas-induced GD3 ganglioside accumulation and efficient apoptosis of lymphoid cells. J Exp Med 187, 897-902 (1998)
70) Quintern LE et al.: Isolation of cDNA clones encoding human acid sphingomyelinase: occurrence of alternatively processed transcripts. EMBO J 8, 2469-2473 (1989)
71) Schissel SL et al.: The cellular trafficking and zinc dependence of secretory and lysosomal sphingomyelinase, two products of the acid sphingomyelinase gene. J Biol Chem 273, 18250-18259 (1998)
72) Bose R et al.: Ceramide synthase mediates daunorubicin-induced apoptosis: an alternative mechanism for generating death signals. Cell 82, 405-414 (1995)
73) Mullen TD et al.: Ceramide synthase-dependent ceramide generation and programmed cell death: involvement of salvage pathway in regulating postmitochondrial events. J Biol Chem 286, 15929-15942 (2011)
74) Tani M et al.: Molecular cloning of the full-length cDNA encoding mouse neutral ceramidase. A novel but highly conserved gene family of neutral/alkaline ceramidases. J Biol Chem 275, 11229-11234 (2000)
75) Mitsutake S et al.: Purification, characterization, molecular cloning, and subcellular distribution of neutral ceramidase of rat kidney. J Biol Chem 276, 26249-26259 (2001)
76) El Bawab S et al.: Molecular cloning and characterization of a human mitochondrial ceramidase. J Biol Chem 275, 21508-21513 (2000)
77) Hwang YH et al.: Subcellular localization of human neutral ceramidase expressed in HEK293 cells. Biochem Biophys Res Commun 331, 37-42 (2005)
78) Ito M et al.: New insight into the structure, reaction mechanism, and biological functions of neutral ceramidase. Biochim Biophys Acta 1841, 682-691 (2014)
79) Kono M et al.: Neutral ceramidase encoded by the Asah2 gene is essential for the intestinal degradation of sphingolipids. J Biol Chem 281, 7324-7331 (2006)
80) Mao C et al.: Cloning of an alkaline ceramidase from Saccharomyces cerevisiae. An enzyme with reverse (CoA-independent) ceramide synthase activity. J Biol Chem 275, 6876-6884 (2000)
81) Coant N et al.: Ceramidases, roles in sphingolipid metabolism and in health and disease. Adv Biol Regul 63, 122-131 (2017)
82) Hannun YA & Obeid LM: Sphingolipids and their metabolism in physiology and disease. Nat Rev Mol Cell Biol 19, 175-191 (2018)
83) Kudo N et al.: Structural basis for specific lipid recognition by CERT responsible for nonvesicular trafficking of ceramide. Proc Natl Acad Sci U S A 105, 488-493 (2008)
84) Inoue T et al.: Mechanistic insights into the hydrolysis and synthesis of ceramide by neutral ceramidase. J Biol Chem 284, 9566-9577 (2009)
85) Nickels JT & Broach JR: A ceramide-activated protein phosphatase mediates ceramide-induced G1 arrest of Saccharomyces cerevisiae. Genes Dev 10, 382-394 (1996)
86) Galadari S et al.: Purification and characterization of ceramide-activated protein phosphatases. Biochemistry 37, 11232-11238 (1998)
87) Dobrowsky RT et al.: Ceramide activates heterotrimeric protein phosphatase 2A. J Biol Chem 268, 15523-15530 (1993)
88) Kishikawa K et al.: Phosphatidic acid is a potent and selective inhibitor of protein phosphatase 1 and an inhibitor of ceramide-mediated responses. J Biol Chem 274, 21335-21341 (1999)
89) Chalfant CE et al.: Long chain ceramides activate protein phosphatase-1 and protein phosphatase-2A. Activation is stereospecific and regulated by phosphatidic acid. J Biol Chem 274, 20313-20317 (1999)
90) Mukhopadhyay A et al.: Direct interaction between the inhibitor 2 and ceramide via sphingolipid-protein binding is involved in the regulation of protein phosphatase 2A activity and signaling. FASEB J 23, 751-763 (2009)
91) Zhang Y et al.: Kinase suppressor of Ras is ceramide-activated protein kinase. Cell 89, 63-72 (1997)
92) Lozano J et al.: Protein kinase C zeta isoform is critical for kappa B-dependent promoter activation by sphingomyelinase. J Biol Chem 269, 19200-19202 (1994)
93) Muller G et al.: PKC zeta is a molecular switch in signal transduction of TNF-alpha, bifunctionally regulated by ceramide and arachidonic acid. EMBO J 14, 1961-1969 (1995)
94) Sathyanarayana P et al.: Activation of the Drosophila MLK by ceramide reveals TNF-alpha and ceramide as agonists of mammalian MLK3. Mol Cell 10, 1527-1533 (2002)
95) Venable ME et al.: Ceramide inhibits phospholipase D in a cell-free system. J Biol Chem 271, 24800-24805 (1996)
96) Abousalham A et al.: Cell-permeable ceramides prevent the activation of phospholipase D by ADP-ribosylation factor and RhoA. J Biol Chem 272, 1069-1075 (1997)
97) Dadsena S et al.: Ceramides bind VDAC2 to trigger mitochondrial apoptosis. Nat Commun 10, 1832 (2019)
98) Fekry B et al.: C16-ceramide is a natural regulatory ligand of p53 in cellular stress response. Nat Commun 9, 4149 (2018)
99) Chen Q et al.: Inverting the Topology of a Transmembrane Protein by Regulating the Translocation of the First Transmembrane Helix. Mol Cell 63, 567-578 (2016)
100) Denard B et al.: Regulating G protein-coupled receptors by topological inversion. Elife 8, e40234 (2019)
101) Winter E & Ponting CP: TRAM, LAG1 and CLN8: members of a novel family of lipid-sensing domains? Trends Biochem Sci 27, 381-383 (2002)
102) Hjelmqvist L et al.: ORMDL proteins are a conserved new family of endoplasmic reticulum membrane proteins. Genome Biol 3, RESEARCH0027 (2002)
103) Moffatt MF et al.: Genetic variants regulating ORMDL3 expression contribute to the risk of childhood asthma. Nature 448, 470-473 (2007)
104) Breslow DK et al.: Orm family proteins mediate sphingolipid homeostasis. Nature 463, 1048-1053 (2010)
105) Siow DL & Wattenberg BW: Mammalian ORMDL proteins mediate the feedback response in ceramide biosynthesis. J Biol Chem 287, 40198-40204 (2012)
106) Xie T et al.: Ceramide sensing by human SPT-ORMDL complex for establishing sphingolipid homeostasis. Nat Commun 14, 3475 (2023)
107) Yatomi Y et al.: Sphingosine 1-phosphate, a bioactive sphingolipid abundantly stored in platelets, is a normal constituent of human plasma and serum. J Biochem 121, 969-973 (1997)
108) Yatomi Y et al.: Sphingosine 1-phosphate induces platelet activation through an extracellular action and shares a platelet surface receptor with lysophosphatidic acid. J Biol Chem 272, 5291-5297 (1997)
109) Okamoto H et al.: EDG1 is a functional sphingosine-1-phosphate receptor that is linked via a Gi/o to multiple signaling pathways, including phospholipase C activation, Ca2+ mobilization, Ras-mitogen-activated protein kinase activation, and adenylate cyclase inhibition. J Biol Chem 273, 27104-27110 (1998)
110) Pinto SN et al.: Effect of ceramide structure on membrane biophysical properties: the role of acyl chain length and unsaturation. Biochim Biophys Acta 1808, 2753-2760 (2011)
111) Holopainen JM et al.: Dimyristoylphosphatidylcholine/C16:0-ceramide binary liposomes studied by differential scanning calorimetry and wide- and small-angle x-ray scattering. Biophys J 78, 2459-2469 (2000)
112) Ruiz-Arguello MB et al.: Different effects of enzyme-generated ceramides and diacylglycerols in phospholipid membrane fusion and leakage. J Biol Chem 271, 26616-26621 (1996)
113) Holopainen JM et al.: Vectorial budding of vesicles by asymmetrical enzymatic formation of ceramide in giant liposomes. Biophys J 78, 830-838 (2000)
114) Andrews NW et al.: Damage control: cellular mechanisms of plasma membrane repair. Trends Cell Biol 24, 734-742 (2014)
115) Trajkovic K et al.: Ceramide triggers budding of exosome vesicles into multivesicular endosomes. Science 319, 1244-1247 (2008)
116) Wu CY et al.: Dihydroceramide desaturase promotes the formation of intraluminal vesicles and inhibits autophagy to increase exosome production. iScience 24, 103437 (2021)
117) Fukushima M et al.: StAR-related lipid transfer domain 11 (STARD11)-mediated ceramide transport mediates extracellular vesicle biogenesis. J Biol Chem 293, 15277-15289 (2018)
118) Barman B et al.: VAP-A and its binding partner CERT drive biogenesis of RNA-containing extracellular vesicles at ER membrane contact sites. Dev Cell 57, 974-994 e978 (2022)
119) Crivelli SM et al.: Function of ceramide transfer protein for biogenesis and sphingolipid composition of extracellular vesicles. J Extracell Vesicles 11, e12233 (2022)
120) Birbes H et al.: Selective hydrolysis of a mitochondrial pool of sphingomyelin induces apoptosis. FASEB J 15, 2669-2679 (2001)
121) Siskind LJ et al.: Ceramide channels increase the permeability of the mitochondrial outer membrane to small proteins. J Biol Chem 277, 26796-26803 (2002)
122) Holleran WM et al.: Regulation of epidermal sphingolipid synthesis by permeability barrier function. J Lipid Res 32, 1151-1158 (1991)
123) Motta S et al.: Abnormality of water barrier function in psoriasis. Role of ceramide fractions. Arch Dermatol 130, 452-456 (1994)
124) Kihara A: Synthesis and degradation pathways, functions, and pathology of ceramides and epidermal acylceramides. Prog Lipid Res 63, 50-69 (2016)
125) Masukawa Y & Tsujimura H: Highly sensitive determination of diverse ceramides in human hair using reversed-phase high-performance liquid chromatography-electrospray ionization mass spectrometry. Lipids 42, 275-290 (2007)
126) Simons K & Toomre D: Lipid rafts and signal transduction. Nat Rev Mol Cell Biol 1, 31-39 (2000)
127) Kusumi A et al.: Membrane mechanisms for signal transduction: the coupling of the meso-scale raft domains to membrane-skeleton-induced compartments and dynamic protein complexes. Semin Cell Dev Biol 23, 126-144 (2012)
128) Simons K & van Meer G: Lipid sorting in epithelial cells. Biochemistry 27, 6197-6202 (1988)
129) Brown DA & Rose JK: Sorting of GPI-anchored proteins to glycolipid-enriched membrane subdomains during transport to the apical cell surface. Cell 68, 533-544 (1992)
130) Schroeder R et al.: Interactions between saturated acyl chains confer detergent resistance on lipids and glycosylphosphatidylinositol (GPI)-anchored proteins: GPI-anchored proteins in liposomes and cells show similar behavior. Proc Natl Acad Sci U S A 91, 12130-12134 (1994)
131) Ostermeyer AG et al.: Glycosphingolipids are not essential for formation of detergent-resistant membrane rafts in melanoma cells. methyl-beta-cyclodextrin does not affect cell surface transport of a GPI-anchored protein. J Biol Chem 274, 34459-34466 (1999)
132) Megha & London E: Ceramide selectively displaces cholesterol from ordered lipid domains (rafts): implications for lipid raft structure and function. J Biol Chem 279, 9997-10004 (2004)
133) Delgado A et al.: Inhibitors of sphingolipid metabolism enzymes. Biochim Biophys Acta 1758, 1957-1977 (2006)
134) Adada M et al.: Inhibitors of the sphingomyelin cycle: Sphingomyelin synthases and sphingomyelinases. Chem Phys Lipids 197, 45-59 (2016)
135) Zweerink MM et al.: Characterization of a novel, potent, and specific inhibitor of serine palmitoyltransferase. J. Biol. Chem. 267, 25032-25038 (1992)
136) Kluepfel D et al.: Myriocin, a new antifungal antibiotic from Myriococcum albomyces. J Antibiot (Tokyo) 25, 109-115 (1972)
137) Fujita T et al.: Fungal metabolites. Part 11. A potent immunosuppressive activity found in Isaria sinclairii metabolite. J. Antibiot. 47, 208-215 (1994)
138) Miyake Y et al.: Serine palmitoyltransferase is the primary target of a sphingosine-like immunosuppressant, ISP-1/myriocin. Biochem. Biophys. Res. Commun. 211, 396-403 (1995)
139) Ikushiro H et al.: Reactions of serine palmitoyltransferase with serine and molecular mechanisms of the actions of serine derivatives as inhibitors. Biochemistry 43, 1082-1092 (2004)
140) Wadsworth JM et al.: The chemical basis of serine palmitoyltransferase inhibition by myriocin. J Am Chem Soc 135, 14276-14285 (2013)
141) Fujita T et al.: Potent immunosuppressants, 2-alkyl-2-aminopropane-1,3-diols. J. Med. Chem. 39, 4451-4459 (1996)
142) Brinkmann V et al.: The immune modulator FTY720 targets sphingosine 1-phosphate receptors. J Biol Chem 277, 21453-21457 (2002)
143) Mandala S et al.: Alteration of lymphocyte trafficking by sphingosine-1-phosphate receptor agonists. Science 296, 346-349 (2002)
144) Cohen JA et al.: Oral fingolimod or intramuscular interferon for relapsing multiple sclerosis. N Engl J Med 362, 402-415 (2010)
145) Kappos L et al.: A placebo-controlled trial of oral fingolimod in relapsing multiple sclerosis. N Engl J Med 362, 387-401 (2010)
146) Sugita M et al.: Ceramidase and ceramide synthesis in human kidney and cerebellum. Description of a new alkaline ceramidase. Biochim Biophys Acta 398, 125-131 (1975)
147) Bielawska A et al.: (1S,2R)-D-erythro-2-(N-myristoylamino)-1-phenyl-1-propanol as an inhibitor of ceramidase. J Biol Chem 271, 12646-12654 (1996)
148) Draper JM et al.: Discovery and evaluation of inhibitors of human ceramidase. Mol Cancer Ther 10, 2052-2061 (2011)
149) Inokuchi J & Radin NS: Preparation of the active isomer of 1-phenyl-2-decanoylamino-3-morpholino-1-propanol, inhibitor of murine glucocerebroside synthetase. J Lipid Res 28, 565-571 (1987)
150) Platt FM et al.: N-butyldeoxynojirimycin is a novel inhibitor of glycolipid biosynthesis. J Biol Chem 269, 8362-8365 (1994)
151) Adachi R et al.: Discovery and characterization of selective human sphingomyelin synthase 2 inhibitors. Eur J Med Chem 136, 283-293 (2017)
152) Qi XY et al.: Discovery of the selective sphingomyelin synthase 2 inhibitors with the novel structure of oxazolopyridine. Bioorg Med Chem Lett 27, 3511-3515 (2017)
153) Yasuda S et al.: A novel inhibitor of ceramide trafficking from the endoplasmic reticulum to the site of sphingomyelin synthesis. J Biol Chem 276, 43994-44002 (2001)
154) Nakao N et al.: Natural ligand-nonmimetic inhibitors to the lipid transfer protein CERT. Comms Chem 2, 20 (2019)
155) Ode T et al.: PDMP, a ceramide analogue, acts as an inhibitor of mTORC1 by inducing its translocation from lysosome to endoplasmic reticulum. Exp Cell Res 350, 103-114 (2017)
156) Cowart LA et al.: Structural determinants of sphingolipid recognition by commercially available anti-ceramide antibodies. J Lipid Res 43, 2042-2048 (2002)
157) Krishnamurthy K et al.: Development and characterization of a novel anti-ceramide antibody. J Lipid Res 48, 968-975 (2007)
158) Waddell T et al.: Globotriosyl ceramide is specifically recognized by the Escherichia coli verocytotoxin 2. Biochem Biophys Res Commun 152, 674-679 (1988)
159) Heyningen SV: Cholera toxin: interaction of subunits with ganglioside GM1. Science 183, 656-657 (1974)
160) Okuda T et al.: Targeted disruption of Gb3/CD77 synthase gene resulted in the complete deletion of globo-series glycosphingolipids and loss of sensitivity to verotoxins. J Biol Chem 281, 10230-10235 (2006)
161) Yamaji A et al.: Lysenin, a novel sphingomyelin-specific binding protein. J Biol Chem 273, 5300-5306 (1998)
162) Kiyokawa E et al.: Spatial and functional heterogeneity of sphingolipid-rich membrane domains. J Biol Chem 280, 24072-24084 (2005)
163) Lipsky NG & Pagano RE: A vital stain for the Golgi apparatus. Science 228, 745-747 (1985)
164) Sleight RG & Pagano RE: Transbilayer movement of a fluorescent phosphatidylethanolamine analogue across the plasma membranes of cultured mammalian cells. J Biol Chem 260, 1146-1154 (1985)
165) Ichikawa S et al.: A mouse B16 melanoma mutant deficient in glycolipids. Proc Natl Acad Sci U S A 91, 2703-2707 (1994)
166) Hanada K et al.: Mammalian cell mutants resistant to a sphingomyelin-directed cytolysin. Genetic and biochemical evidence for complex formation of the LCB1 protein with the LCB2 protein for serine palmitoyltransferase. J. Biol. Chem. 273, 33787-33794 (1998)
167) Fukasawa M et al.: Genetic evidence for ATP-dependent endoplasmic reticulum-to-Golgi apparatus trafficking of ceramide for sphingomyelin synthesis in Chinese hamster ovary cells. J Cell Biol 144, 673-685 (1999)
168) Sabourdy F et al.: Functions of sphingolipid metabolism in mammals–lessons from genetic defects. Biochim Biophys Acta 1781, 145-183 (2008)
169) Allende ML & Proia RL: Simplifying complexity: genetically resculpting glycosphingolipid synthesis pathways in mice to reveal function. Glycoconj J 31, 613-622 (2014)
170) Hirabayashi Y et al.: A novel glycosphingolipid hydrolyzing enzyme, glycosphingolipid ceramide deacylase, which cleaves the linkage between the fatty acid and sphingosine base in glycosphingolipids. J Biochem 103, 1-4 (1988)
171) Mitsutake S et al.: [14C]ceramide synthesis by sphingolipid ceramide N-deacylase: new assay for ceramidase activity detection. Anal Biochem 247, 52-57 (1997)
172) Dawkins JL et al.: Mutations in SPTLC1, encoding serine palmitoyltransferase, long chain base subunit-1, cause hereditary sensory neuropathy type I. Nat. Genet. 27, 309-312 (2001)
173) Bejaoui K et al.: SPTLC1 is mutated in hereditary sensory neuropathy, type 1. Nat. Genet. 27, 261-262 (2001)
174) Rotthier A et al.: Mutations in the SPTLC2 subunit of serine palmitoyltransferase cause hereditary sensory and autonomic neuropathy type I. Am J Hum Genet 87, 513-522 (2010)
175) Mwinyi J et al.: Plasma 1-deoxysphingolipids are early predictors of incident type 2 diabetes mellitus. PLoS One 12, e0175776 (2017)
176) Alecu I et al.: Cytotoxic 1-deoxysphingolipids are metabolized by a cytochrome P450-dependent pathway. J Lipid Res 58, 60-71 (2017)
177) Steiner R et al.: Elucidating the chemical structure of native 1-deoxysphingosine. J Lipid Res 57, 1194-1203 (2016)